专题4 分子空间结构与物质性质 知识点题库
-
(1) CS2分子中的C原子采取杂化,分子的结构式为,立体构型为;
-
(2) CH2O中的C原子采取杂化,分子的结构式为,立体构型为;
-
(3) CCl4分子中的C原子采取杂化,分子的结构式为,立体构型为;
-
(4) H2S分子中的S原子采取杂化,分子的结构式为,立体构型为。
-
(1) 铁、钴、镍的基态原子核外未成对电子数最多的是。
-
(2) 酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为(用相应的元素符号表示);氮原子的杂化轨道类型为。

-
(3) Fe(CO)x , 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x , 晶体属于(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=。
-
(4) NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiOFeO(填“>”“<”或“=”),原因是。
-
(5) NiAs的晶胞结构如图所示:

①镍离子的配位数为。
②若阿伏加德罗常数的值为NA , 晶体密度为pg·cm-3 , 则该晶胞中最近的Ni2+之间的距离为cm。(写出计算表达式)
 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
-
(1) 铁元素在元素周期表中的位置为,其价层电子排布图为。
-
(2) 组成“摩尔盐”的非金属元素中第一电离能最大的元素为。“摩尔盐”的分解产物中属于非极性分子的化合物是。
-
(3) NH3的沸点比N2O的沸点(填“高”或“低”),其主要原因是。
-
(4) K3[Fe(CN)6]常用于检验Fe2+ , K3[Fe(CN)6]中除了离子键以外还存在的化学键为,与CN—互为等电子体的单质的分子式为。HCN分子中σ键和π键的个数之比为。
-
(5) FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为,若该晶胞边长为acm,则该晶胞密度为g/cm3。
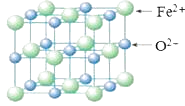

-
(1) 基态亚铜离子中电子占据的原子轨道数目为。
-
(2) 若基态硒原子价层电子排布式写成4s24p4p,则其违背了。
-
(3) 上图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是(填标号)。
-
(4) 元素X与硅同主族且原子半径最小,X形成的最简单氢化物Q的电子式为,该分子其中心原子的杂化类型为。
写出一种与Q互为等电子体的离子。
-
(5) 与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]·8H2O。其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
________________(填字母)。
 A . 离子键 B . 共价键 C . 金属键 D . 范德华力 E . 氢键
A . 离子键 B . 共价键 C . 金属键 D . 范德华力 E . 氢键 -
(6) GaAs的熔点为1 238 ℃,密度为ρ g·cm-3 , 其晶胞结构如图所示。

已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为,GaAs的熔点(填“高于”或“低于”)GaN。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1 , 原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA , 则GaAs晶胞中原子的体积占晶胞体积的百分率为。
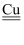 NF3+3NH4F.Ka(HF)=6.3×10−4 , Kb(NH3·H2O)=1.8×10−5。下列说法正确的是( )
NF3+3NH4F.Ka(HF)=6.3×10−4 , Kb(NH3·H2O)=1.8×10−5。下列说法正确的是( )
 F
B . HF的电子式:
F
B . HF的电子式: 


-
(1) 氧族元素各基态原子第一电离能随原子序数增大依次减小的原因为。
-
(2) Zr(ClO4)4是一种常见的锆盐,ClO4—的空间构型为,其中Cl原子的杂化方式为。
-
(3) 如图为硒化锆的分子结构(图甲)和氧化锆的晶胞结构(图乙)。

①硒化锆的沸点远低于氧化锆,原因为,硒化锆和氧化锆的配位数分别为、。
②已知阿伏加德罗常数的值为NA , 据图乙中数据计算氧化锆的密度为g‧cm-3(用含NA和a的代数式表示,列式即可)

 的空间构型为平面三角形
C . M、Y、Z三种元素形成的化合物溶于水均会抑制水的电离
D . 工业上采用电解W的氯化物水溶液的方法制取W的单质
的空间构型为平面三角形
C . M、Y、Z三种元素形成的化合物溶于水均会抑制水的电离
D . 工业上采用电解W的氯化物水溶液的方法制取W的单质
-
(1) Co在周期表中的位置是,基态Co的电子占据的最高能层符号为。
-
(2) 钴盐引发动物中毒时,通常可以用EDTA(结构如图)解毒。其中,N的杂化方式均为,N的I1(第一电离能)大于O的I1 , 其原因是;自由基是指含单电子的基团,1mol -COOH(羧基自由基)中存在mol σ键和mol π键。

-
(3) EDTA可以由乙二胺与甲醛、氰化钠间接得到。离子化合物氰化钠的晶体类型为,甲醛分子的空间构型为。
-
(4) Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为,Co总的空隙填充率为,如果晶胞边长为a nm,Co3O4的摩尔质量为M g/mol,NA为阿伏加德罗常数的值,则Co3O4的晶体密度为g/cm3(列出计算式)。

-
(1) 基态Cu原子中,核外电子占据最高能层的符号是。
-
(2) 原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用
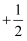 表示,与之相反的用
表示,与之相反的用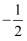 表示,
表示,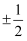 即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为。
即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为。
-
(3) 铜锰氧化物(
 )能在常温下催化氧化甲醛(结构如图)生成甲酸。
)能在常温下催化氧化甲醛(结构如图)生成甲酸。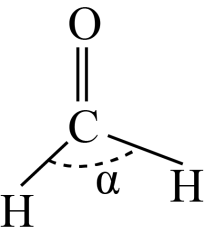
①
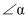 (填“>”、“=”或“<”)120°;从原子轨道重叠方式分类,分子中
(填“>”、“=”或“<”)120°;从原子轨道重叠方式分类,分子中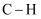 键的类型是。
键的类型是。②气态时,测得甲酸的相对分子质量大于46,其原因可能是。
-
(4)
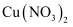 是有机催化剂,其溶液为天蓝色。
是有机催化剂,其溶液为天蓝色。①使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则
 的杂化轨道类型为(填标号)。
的杂化轨道类型为(填标号)。A.
 B.sp C.
B.sp C.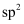 D.
D.
②
 的空间构型为;分子中的大π键可用符号
的空间构型为;分子中的大π键可用符号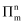 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为。
中的大π键应表示为。 -
(5) Co晶体堆积方式为六方最密堆积,其晶胞结构如图所示,已知Co的原子半径为r,该晶胞的空间利用率为(晶胞上占有的原子的体积与晶胞体积之比为晶胞的空间利用率,用含π的代数式表示)。

-
(1) 二茂铁[
 ]是由一个二价铁离子和2个环戊烯基负离子构成,熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为晶体,在二茂铁结构中,
]是由一个二价铁离子和2个环戊烯基负离子构成,熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为晶体,在二茂铁结构中, 与
与 之间形成的化学键类型是。
之间形成的化学键类型是。
-
(2) 向黄色的三氯化铁溶液中加入无色的
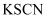 溶液,溶液变成红色。可用方程式
溶液,溶液变成红色。可用方程式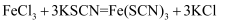 表示。经研究表明,
表示。经研究表明, 是配合物,
是配合物, 与
与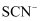 不仅能以
不仅能以 的个数比配合,还可以其他个数比配合。
的个数比配合,还可以其他个数比配合。①所得
 与
与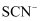 的配合物中,主要是
的配合物中,主要是 与
与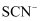 以个数比
以个数比 配合所得离子显红色。含该离子的配合物的化学式是。
配合所得离子显红色。含该离子的配合物的化学式是。②铁的另一种配合物铁氰化钾
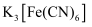 俗称赤血盐,可用于检验
俗称赤血盐,可用于检验 , 两者反应生成带有特征蓝色的沉淀,该赤血盐中心原子的配位数是,请写出一种与其配体互为等电子体的分子。
, 两者反应生成带有特征蓝色的沉淀,该赤血盐中心原子的配位数是,请写出一种与其配体互为等电子体的分子。 -
(3) 已知
 的立体结构如下图,其中1~6处的小圆圈表示
的立体结构如下图,其中1~6处的小圆圈表示 分子,且各相邻的
分子,且各相邻的 分子间的距离相等(图中虚线长度相等)。
分子间的距离相等(图中虚线长度相等)。 位于八面体的中心,若其中两个
位于八面体的中心,若其中两个 被
被 取代,所形成的
取代,所形成的 的结构有种。
的结构有种。

-
(1) 基态氟原子的轨道表示式为,其处于最高能级的电子云轮廓图为。
-
(2) 三氟化氮(
 )和三氯化氮(
)和三氯化氮( )是两种强氧化剂。
)是两种强氧化剂。①
 中N原子的杂化轨道类型为,分子的空间构型为。
中N原子的杂化轨道类型为,分子的空间构型为。②
 的键角小于
的键角小于 的原因为。
的原因为。 -
(3)
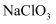 是一种重要的化工原料,
是一种重要的化工原料, 的VSEPR模型为。
的VSEPR模型为。
-
(4) 氟化钙和氯化钙均为离子晶体,其中氟化钙的立方晶胞图如图所示。已知氟化钙晶胞参数为a pm,
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。
①每个氟化钙晶胞中含有
 的数目为个;离子晶体中离子的配位数是指一个离子周围最近的异电性离子的数目,则
的数目为个;离子晶体中离子的配位数是指一个离子周围最近的异电性离子的数目,则 的配位数为。
的配位数为。②以“
 ”表示
”表示 , “
, “ ”表示
”表示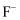 , 画出氟化钙晶胞沿z轴方向投影图。
, 画出氟化钙晶胞沿z轴方向投影图。③氟化钙的密度为
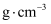 (列出计算式)。
(列出计算式)。



