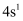专题5 物质结构的探索无止境 知识点题库
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)

-
(1) 化合物M的空间构型为 ,其中心原子采取 杂化;化合物N在固态时的晶体类型为
-
(2) R、X、Y三种元素的第一电离能由小到大的顺序为
-
(3) 由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)
-
(4) 由R、X、Y三种元素组成的RXY﹣离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质.该反应的离子方程式为
-
(5) Z原子基态时的外围电子排布式为 ;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为

-
(1) 在如图的模型中, 处表示的是双键(填A、B、C、D);Z的核外共有 种不同能量的电子,有 个未成对电子.X形成的单质晶体可能为 .
a.离子晶体b.分子晶体c.原子晶体d.金属晶体
-
(2) Y与W可形成YW5的化合物,有关该物质的叙述不正确的是 .
A、离子化合物,固态时是离子晶体
B、溶于水所形成的溶液显碱性
C、投入少量水中,有两种气体产生
D、YW5中Y的化合价为﹣5价
-
(3) 下列可以验证Y与Z两元素原子得电子能力强弱的实验事实是 .
A、比较这两种元素的气态氢化物的沸点
B、比较这两种元素最高价氧化物对应水化物的酸性
C、比较这两种元素的气态氢化物的稳定性
D、比较这两种元素的单质与氢气化合的难易
-
(4) X、Y、Z、W四种元素组成的某无机盐,既可与盐酸反应,又可以与NaOH溶液反应,其化学式为 ,在这四种元素中,一种元素的单质在加热时能够与另外三种元素组成的具有强氧化性的化合物反应,写出该反应的化学方程式:
-
(1) 基态溴原子的核外电子排布式为[Ar]。
-
(2) 在一定浓度的HF溶液中,氟化氢是以缔合形式(HF)2存在的。使氟化氢分子缔合的作用力是。
-
(3) HIO3的酸性(填“强于”或“弱于”) HIO4 , 原因是。
-
(4) ClO2-中心氯原子的杂化类型为,ClO3-的空间构型为。
-
(5) 晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(
 ,
,  ,0);C处为(1,1,1)。则D处微粒的坐标参数为。
,0);C处为(1,1,1)。则D处微粒的坐标参数为。 

②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为cg·cm-3 , 则晶胞中Ca2+与离它最近的F-之间的距离为nm (设NA为阿伏加德罗常数的值,用含C、NA的式子表示;相对原子质量:Ca 40 F 19)。
-
(1) 镓元素位于元素周期表的周期族,砷原子核外的电子有种运动状态。
-
(2) Si、P、S 的第一电离能由大到小的顺序是 , 二氧化硅和干冰晶体的熔点差别很大,其原因是。
-
(3) 与AsF3互为等电子体的分子为(只写一中),其空间构型为。
-
(4) 硼酸(H3BO3)本身不能电离出H+ , 在水溶液中易结合一个OH-生成[B(OH)4]- , 而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为。
②[B(OH)4]-的结构式为。
-
(5) 金刚石的晶胞如图所示,

若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 金刚石晶胞的密度为g/cm3(只要求列算式,阿伏加德罗常数为NA)。
-
(1) 绿矾的化学式是。
-
(2) 热稳定性H2O大于H2S的主要原因是。
-
(3) 写出镁在二氧化碳中燃烧的化学反应方程式:。
 和
和  ,其历程示意图如图(图中只画出了HAP的部分结构)。
,其历程示意图如图(图中只画出了HAP的部分结构)。 
下列说法错误的是( )
 的平衡转化率
B . HCHO在反应过程中,有
的平衡转化率
B . HCHO在反应过程中,有 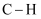 键发生断裂
C . 根据图示信息,
键发生断裂
C . 根据图示信息,  分子中的氧原子全部来自
分子中的氧原子全部来自  D . 该过程的总反应是
D . 该过程的总反应是 
 )可看作氨分子内的一个氢原子被羟基取代的衍生物。下列说法错误的是( )
)可看作氨分子内的一个氢原子被羟基取代的衍生物。下列说法错误的是( )
 原子、
原子、  原子与羟基
原子与羟基 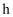 原子共线
原子共线
 等。
等。
-
(1)
 , 中所含元素H、O、P、S的电负性从大到小的顺序为 ;CH3NH2的沸点是-6.8℃,CH3CH3的沸点是-88.6℃ ,CH3NH2的沸点远高于CH3CH3的沸点的原因是。
, 中所含元素H、O、P、S的电负性从大到小的顺序为 ;CH3NH2的沸点是-6.8℃,CH3CH3的沸点是-88.6℃ ,CH3NH2的沸点远高于CH3CH3的沸点的原因是。
-
(2) H2O、H2S、H2Se中最稳定的是(填化学式,下同),还原性最强的是,键角最大的是。
-
(3) SO3和O3的混合气体经光解作用可生成一种新分子
 。
。①SO3中S的杂化轨道与O的2p轨道重叠形成σ键。
②下列分子中属于非极性分子的是 (填序号)。
a.SO3
b.O3
c.

d.CH3F
e.P4
-
(4) 已知酸性:ClCH2COOH>CH3COOH。推测酸性:ClCH2COOH(填“>”或“<")FCH2COOH。
-
(1) 钒(V)及其化合物广泛应用于工业催化、新材料等领域。
①基态钒原子的价电子排布式为。
②
 是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:
是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示: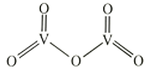
则
 分子中σ键和π键数目之比为。
分子中σ键和π键数目之比为。 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。
溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。 与
与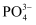 的空间构型相同,其中V原子的杂化方式为。
的空间构型相同,其中V原子的杂化方式为。 -
(2) ①科学研究表明用
 作光催化剂可处理废水中的
作光催化剂可处理废水中的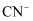 , 则
, 则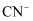 的电子式为。
的电子式为。②
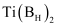 是一种储氢材料。基态B原子核外电子的运动状态有种。
是一种储氢材料。基态B原子核外电子的运动状态有种。 -
(3) 甘氨酸亚铁络合物[
 ]广泛用于缺铁性贫血的预防和治疗。
]广泛用于缺铁性贫血的预防和治疗。①
 中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。
中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。②甘氨酸 (
 )的沸点比相对分子质量相近的烷烃大很多,原因是。
)的沸点比相对分子质量相近的烷烃大很多,原因是。
N—N | N≡N | P—P | P≡P |
193 | 946 | 197 | 489 |
下列说法错误的是( )
 )能量更低所以通常以N2形式存在
C . 从原子半径角度看,因为P原子半径较大不易形成π键
D . P4分子中P原子采取sp3杂化
)能量更低所以通常以N2形式存在
C . 从原子半径角度看,因为P原子半径较大不易形成π键
D . P4分子中P原子采取sp3杂化
 )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某 的晶胞如图1所示,
的晶胞如图1所示, 可以完全替代该晶体中m位置
可以完全替代该晶体中m位置 或n位置
或n位置 , 形成
, 形成 替代型产物。
替代型产物。 转化为两种
转化为两种 替代型产物的能量变化如图2所示。下列说法错误的是 ( )
替代型产物的能量变化如图2所示。下列说法错误的是 ( )
 晶胞中
晶胞中 与
与 之间的最短距离为
之间的最短距离为 C . 当m位置的
C . 当m位置的 位于体心时,n位置的
位于体心时,n位置的 位于棱心
D . 两种产物中,更稳定的
位于棱心
D . 两种产物中,更稳定的 替代型产物的化学式为
替代型产物的化学式为
-
(1) 基态Co2+的电子排布式为。
[Co(NH3)6]2+脱除烟气中NO的机理如下:

-
(2) Ⅰ.活化氧气:[Co(NH3)6]2+在氨水中与氧气作用生成具有强氧化性的微粒X(其中Co的化合价为+3),X的结构如上图所示。
用“☐”标识出X中体现强氧化性的基团:。
-
(3) X中含有的配位键的数目为。
-
(4) Ⅱ.配位[Co(NH3)6]2+较钴的其它配位离子易吸收NO生成[Co(NH3)5NO]2+ , 将NO由气相转入液相。溶液的pH对NO的配位脱除率的影响如图所示。

图中pH=9.75时,NO脱除率较低,其原因可能是。
-
(5) 同一pH下,随着反应的进行,NO的脱除率下降,可能原因是。
-
(6) 写出[Co(NH3)5NO2]2+在氨水中反应生成硝酸铵和亚硝酸铵的离子方程式:。
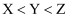 C . X与Y不可能组成化合物
C . X与Y不可能组成化合物 D . W的价电子排布为
D . W的价电子排布为