第3节 化学中常用的物理量-物质的量 知识点题库
 L
C . 2×107×22.4 L
D .
L
C . 2×107×22.4 L
D .  ×22.4 L
×22.4 L
①0.5mol氨气 ②1g氢气 ③4℃时9mL水④0.2mol磷酸钠.

-
(1) 该“84消毒液”的物质的量浓度约为mol·L-1。(保留小数点后一位)
-
(2) 某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=mol·L-1。
-
(3) 该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是__(填字母)。
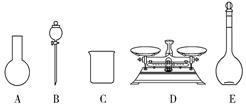 A . 如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 B . 容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 C . 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 D . 需要称量NaClO固体的质量为143.0 g
A . 如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 B . 容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 C . 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 D . 需要称量NaClO固体的质量为143.0 g -
(4) “84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2L2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为mol·L-1。
②需用浓硫酸的体积为mL。
-
(1) 已知3.01×1023个氖原子的质量为w g,则氖气的摩尔质量是。
-
(2) 在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为。若其中CO和N2的物质的量之比为1: 1,则混合气体中氧元素的质量分数为。(保留3位有效数字)
-
(3) 将25℃ 101KPa条件下49 L的NH3气体(注:该条件下气体摩尔体积为24.5 L/mol)溶于166ml(ρ=1g/cm3)的水中,所得氨水的密度为0.8 g/cm3 , 该氨水的物质的量浓度为,取出30.0 ml该溶液,配成4.0 mol/L的稀溶液,则稀释后溶液的体积为ml。
①用稀醋酸和稀氢氧化钠溶液反应测定中和热数值;②用滴定管量取液体时,开始时平视读数,结束时俯视读数所得溶液的体积;③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;④在用标准液(已知浓度)滴定未知溶液时,盛标准液的滴定管水洗后未润洗;⑤定容时,仰视容量瓶的刻度线

已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
-
(1) (实验一) 制备NaClO溶液(实验装置如图所示)
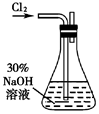
配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____(填标号)
A . 容量瓶 B . 烧杯 C . 烧瓶 D . 玻璃棒 -
(2) 锥形瓶中发生反应化学程式是。
-
(3) (实验二) 制取水合肼。(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
分液漏斗中的溶液是(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是。蒸馏时需要减压,原因是。
-
(4) (实验三) 测定馏分中肼含量。
水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
-
(5) 滴定时,碘的标准溶液盛放在滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式。
-
(6) 若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为。
A.用量筒量取5.4mL浓硫酸,缓缓注入盛有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌
B.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶里
C.将稀释后的稀硫酸小心地用玻璃棒引流入容量瓶
D.检查100mL容量瓶口部是否发生滴漏
E.将蒸馏水直接加入容量瓶,至液面接近环形刻度线1~2cm处
F.盖紧瓶塞,反复倾倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切
请回答下列问题:
-
(1) 正确的操作顺序是(填标号)。
-
(2) 进行A步操作时,应选用下列量器中的(填标号)。
①10mL量筒 ②50mL量筒 ③500mL量筒 ④1000mL量筒
-
(3) 如果对装有浓硫酸的量筒仰视读数为5.4mL,配制的稀硫酸的浓度将(填“偏高”“偏低”或“无影响”)。
-
(4) 进行A步操作时,必须后,才能进行后面的操作。
-
(5) 配制上述溶液时,下列操作会导致所配溶液的浓度偏高的是(填标号)。
a.洗涤烧杯和玻璃棒的溶液未转移入容量瓶中
b.定容时,眼睛俯视使溶液凹面最低点与容量瓶刻度线相切
c.容量瓶中原残留有少量蒸馏水
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
 草酸(H2C2O4)溶液中含有H+的数目为0.1NA
C . 标准状况下,11.2L1H37Cl气体中含有的中子数为10NA
D . 0.1mol铁与0.1molCl2充分反应,转移的电子数为0.2NA
草酸(H2C2O4)溶液中含有H+的数目为0.1NA
C . 标准状况下,11.2L1H37Cl气体中含有的中子数为10NA
D . 0.1mol铁与0.1molCl2充分反应,转移的电子数为0.2NA



