第2节 弱电解质的电离、盐类的水解 知识点题库
NH3及其盐都是重要的化工原料.
(1)用NH4Cl和Ca(OH)2制备NH3的化学方程式为 ;该反应发生、气体收集和尾气处理装置如图1依次为 ;
(2)按如图2装置进行NH3性质实验.先打开旋塞1,B瓶中的现象是 ,稳定后,关闭旋塞1.再打开旋塞2,B瓶中的现象是 ;
(3)写出NH4Cl溶液水解的离子方程式 ;
设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、250mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究对溶液中NH4Cl水解程度的影响;
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
|
物理量 实验序号 |
V(溶液)/mL |
NH4Cl质量/g |
温度/℃ |
|
… |
|
1 |
250 |
|
|
X |
… |
|
2 |
250 |
|
|
|
… |
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为X,则NH4Cl水解反应的平衡转化率为 (只列出算式,忽略水自身电离的影响).

-
(1) 常温下,在纯水中加入某一元酸钠盐NaA使溶液的pH=9,则该溶液中水电离出来的C(OH﹣)=mol•L﹣1 , KW值(填增大、减小或不变).
-
(2) 将锌片与铜片用导线连接插入硫酸铜溶液时,锌片上释放的电子沿流向铜片,阳离子从极到极.不纯的金属或合金与空气中的水溶液接触,发生原电池反应而腐蚀的过程是金属腐蚀的主要形式.当生铁表面的水膜酸性较强时产生腐蚀,其负极的电极反应式为.正极的电极反应式为.当水膜酸性很弱或呈中性时,正极的电极反应为.
①其它条件不变时,缩小容器体积,平衡H2(g)+I2(g)⇌2HI(g)不移动,体系颜色不变
②常温下,  =10﹣10的溶液中:Na+、Al3+、SO42﹣、NO3﹣可大量共存
=10﹣10的溶液中:Na+、Al3+、SO42﹣、NO3﹣可大量共存
③将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
④为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸.
-
(1) 某温度下,在Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=3.2×10﹣11)、AgCl(Ksp=1.8×10﹣10)三种物质中,溶解度最小的是
-
(2) 在粗制CuSO4•5H2O晶体中常含有杂质Fe2+ . 在提纯时为了除去Fe2+ , 常加入氧化剂,使Fe2+氧化为Fe3+ , 下列物质最合适的是
A.KMnO4 B.H2O2 C.Cl2 水 D.HNO3
已知KMnO4氧化Fe2+时,生成Mn2+离子,试写出酸性KMnO4与Fe2+反应的离子反应方程式;然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3 , 可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A.NaOH B. NH3•H2O C.CuCO3 D.Cu(OH)2
-
(3) 甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10﹣38 , Cu(OH)2的溶度积Ksp=3.0×10﹣18 , 通常认为残留在溶液中的离子浓度小于1×10﹣5 mol•L﹣1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L﹣1 , 则Cu(OH)2开始沉淀时溶液的pH为,Fe3+完全沉淀时溶液的pH为(已知lg2=0.3,lg5=0.7),通过计算确定上述方案(填“可行”或“不可行”)
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 纯碱是强碱弱酸盐 | 用纯碱溶液可清洗油污 |
B | 不锈钢是合金 | 不锈钢在潮湿环境中容易被腐蚀 |
C | Fe2O3是碱性氧化物 | Fe2O3可用作红色油漆和涂料 |
D | NO2是红棕色气体 | 常温下可用铜与浓硝酸制取NO2 |
-
(1) 写出酸H2A的电离方程式.
-
(2) 若溶液M由10mL2mol⋅L−1NaHA溶液与2mol⋅L−1NaOH溶液等体积混合而得,则溶液M的pH7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为.
已知Ksp(BaA)=1.8×10−10,向该混合溶液中加入10mL1mol⋅L−1BaCl2溶液,混合后溶液中的Ba2+浓度为mol⋅L−1.
-
(3) 若溶液M由pH=3的H2A溶液V1mL与pH=11的NaOH溶液V2mL混合反应而得,混合溶液c(H+)c(OH−)=104,V1与V2的大小关系为(填“大于”“等于”“小于”或“均有可能”).
| 实验 序号 | c(盐酸)/ (mol·L-1) | c(MOH)/ (mol·L-1) | 反应后溶 液的pH |
| 甲 | 0.20 | 0.20 | 5 |
| 乙 | 0.10 | a | 7 |
 溶液滴加到
溶液滴加到  溶液中,混合溶液的
溶液中,混合溶液的  与离子浓度变化的关系如图所示(纵坐标为
与离子浓度变化的关系如图所示(纵坐标为  或
或  。下列叙述错误的是( )
。下列叙述错误的是( ) 
 与
与  B . 图中a点对应溶液中:
B . 图中a点对应溶液中:  C .
C .  与
与  之比为
之比为 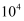 D .
D . 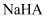 溶液中:
溶液中: 
 (已电离的电解质/原有电解质)×100%。已知25 ℃时几种物质(微粒)的电离度(溶液浓度均为0.1
(已电离的电解质/原有电解质)×100%。已知25 ℃时几种物质(微粒)的电离度(溶液浓度均为0.1  )如表所示:
)如表所示: | 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步 | 10% |
| B | 硫酸氢钠溶液: | 29% |
| C | 醋酸: | 1.33% |
| D | 盐酸: | 100% |
-
(1) 25℃ 时,上述几种溶液中
 从大到小的顺序是(填序号)。
从大到小的顺序是(填序号)。
-
(2) 25℃ 时,0.1
 硫酸溶液中
硫酸溶液中  的电离度小于相同温度下0.1
的电离度小于相同温度下0.1  硫酸氢钠溶液中
硫酸氢钠溶液中  的电离度,其原因是。
的电离度,其原因是。
-
(3) 醋酸的电离平衡常数
 的表达式是,则物质的量浓度为
的表达式是,则物质的量浓度为  的醋酸的电离平衡常数
的醋酸的电离平衡常数  与电离度α的关系为
与电离度α的关系为  (用含
(用含  的代数式表示)。
的代数式表示)。
-
(4) 25℃时,纯水密度约为1g/mL。纯水的电离度约为
 溶液中,
溶液中, B . 向
B . 向 溶液中滴加少量澄清石灰水,
溶液中滴加少量澄清石灰水, 减小
C . 0.1
减小
C . 0.1 的
的 溶液中,因为
溶液中,因为 的水解,阴离子浓度之和小于0.1
的水解,阴离子浓度之和小于0.1 D . 常温下,向含有0.05mol NH3·H2O的溶液中,通入适量的HCl气体,反应所得的溶液中c(NH
D . 常温下,向含有0.05mol NH3·H2O的溶液中,通入适量的HCl气体,反应所得的溶液中c(NH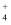 )= c(NH3•H2O),此时溶液为碱性(已知常温下NH3·H2O的电离常数为
)= c(NH3•H2O),此时溶液为碱性(已知常温下NH3·H2O的电离常数为 )
)
 氨水中滴加盐酸,溶液中由水电离出的
氨水中滴加盐酸,溶液中由水电离出的 随加入盐酸体积的变化如图所示。则下列说法正确的是( )
随加入盐酸体积的变化如图所示。则下列说法正确的是( )
 、
、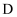 两点均为中性溶液
B .
两点均为中性溶液
B .  点溶液中,
点溶液中, C .
C .  、
、 之间的任意一点:
之间的任意一点: ,
, 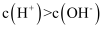 D . 常温下,
D . 常温下, 的电离常数K约为
的电离常数K约为
 B . pH相等的盐酸和醋酸溶液,则
B . pH相等的盐酸和醋酸溶液,则 C .
C .  溶液呈酸性,则
溶液呈酸性,则 一定是强酸
D . 若溶液中
一定是强酸
D . 若溶液中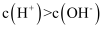 , 则溶液一定呈酸性
, 则溶液一定呈酸性
 溶液中含铁微粒的分布系数与pH的关系如图所示。下列说法正确的是( )
溶液中含铁微粒的分布系数与pH的关系如图所示。下列说法正确的是( )
 的数量级为
的数量级为 B . 不论溶液酸碱性如何变化,铁元素都有4种存在形式
C . 向pH=2的这种溶液中加氢氧化钠至pH=10,
B . 不论溶液酸碱性如何变化,铁元素都有4种存在形式
C . 向pH=2的这种溶液中加氢氧化钠至pH=10, 的分布分数逐渐增大
D .
的分布分数逐渐增大
D .  既能与强酸又能与强碱反应
既能与强酸又能与强碱反应






