活动1 常见离子的检验 知识点题库
①氢氧化亚铁在空气中最终变为灰绿色;
②淀粉溶液遇单质碘变为蓝色;
③向硫酸铁溶液中加入KSCN变为红色
④新制氯水久置后变为无色;
⑤无水硫酸铜吸收水蒸气变成浅绿色;
⑥品红溶液通入过量二氧化硫后褪色.
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
-
(1) 实验1中产生白色沉淀的离子方程式是。
-
(2) 为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
① 甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3 , 方案是。
② 乙同学查阅文献:Fe(OH)2在大量SO42存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入,再往试管中加入,振荡,现象与实验1相同,结论是该假设不成立。
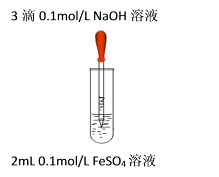
③ 乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10 mL
NaOH溶液
滴加
FeSO4溶液
实验现象
实验2
6 mol/L
NaOH溶液
0.2mol/L FeSO4溶液
产生悬浮于液面的白色沉淀(带有少量灰绿色) ,沉淀下沉后,大部分灰绿色变为白色沉淀
实验3
6 mol/L
NaOH溶液
0.1mol/L FeSO4溶液
产生悬浮于液面的白色沉淀(带有极少量灰绿色) ,沉淀下沉后,底部都为白色沉淀
该实验得出的结论是,能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是,证明该假设成立。
-
(3) 丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为。
-
(4) 根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件。
 :先加氯水,再加KSCN,若变红,则有Fe2+
B . 检验NH4+:先加NaOH,加热,用蓝色石蕊试纸检验,若变红,则有NH4+
C . 检验Cl-:先加AgNO3 , 再加HNO3 , 若有白色沉淀,则有Cl-
D . 检验
:先加氯水,再加KSCN,若变红,则有Fe2+
B . 检验NH4+:先加NaOH,加热,用蓝色石蕊试纸检验,若变红,则有NH4+
C . 检验Cl-:先加AgNO3 , 再加HNO3 , 若有白色沉淀,则有Cl-
D . 检验 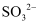 :先加HNO3 , 将生成的气体通入品红,若品红褪色,则有
:先加HNO3 , 将生成的气体通入品红,若品红褪色,则有 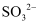

已知:[Cu(NH3)4]2++4H+=Cu2++4NH4+
请回答:
-
(1) 步骤①中,试剂X应采用。
-
(2) 甲、乙两同学取相同量的溶液Y分别进行蒸馏,收集到的馏出液体积相近,经检测,甲同学的馏出液中乙醇的含量明显偏低,可能的原因是。
-
(3) 设计实验方案验证硫酸铜铵固体中的NH4+。
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜
②室温下,不能将浓硫酸盛放在铁桶中 ③K+、Fe3+、NO3-、SCN﹣在水溶液中能大量共存
④因氧化铁能与酸反应,可用于制作红色涂料 ⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质.

回答下列问题:
-
(1) 在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为。
-
(2) “滤渣1”的主要成分有。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是。
-
(3) 根据H3BO3的解离反应:H3BO3+H2O
 H++B(OH)−4 , Ka=5.81×10−10 , 可判断H3BO3是酸;在“过滤2”前,将溶液pH调节至3.5,目的是。
H++B(OH)−4 , Ka=5.81×10−10 , 可判断H3BO3是酸;在“过滤2”前,将溶液pH调节至3.5,目的是。
-
(4) 在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为,母液经加热后可返回工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是。

 溶液,反应的化学方程式是
溶液,反应的化学方程式是  ,再加入几滴0.1mol/LKSCN溶液。下列说法正确的是( )
,再加入几滴0.1mol/LKSCN溶液。下列说法正确的是( )
 能全部转化为
能全部转化为  B . 向
B . 向  、
、  和KCl反应后的混合溶液中加入几滴KSCN溶液,溶液显红色
C . 实验中KSCN溶液用于检验
和KCl反应后的混合溶液中加入几滴KSCN溶液,溶液显红色
C . 实验中KSCN溶液用于检验  D . 向2mL0.01molLKI和
D . 向2mL0.01molLKI和  的混合溶液中加入淀粉溶液,溶液呈蓝色
的混合溶液中加入淀粉溶液,溶液呈蓝色

回答下列问题:
-
(1) 在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是。
-
(2) 在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:。
-
(3) 实验室中,检验溶液中含有NH4+ 的操作方法是。
-
(4) 物质B为红棕色气体,写出该物质与水反应的离子方程式: ,当反应消耗0.15 mol物质B时,转移电子的物质的量为。
| 选项 | 操作 | 现象 | 结论 |
| A | 往FeCl3溶液中加入少量铜粉 | 铜粉溶解 | 氧化性:Cu2+>Fe3+ |
| B | 向AgCl浊液中加入少量0.1mol/LKI溶液 | 白色沉淀颜色变黄 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中滴加几滴新制氯水,再滴加少量KSCN溶液 | 溶液变红色 | 某溶液中含有Fe2+ |
| D | 将稀H2SO4滴加到饱和Na2SO3溶液中,将产生的气体通入KMnO4溶液 | 紫色溶液褪去 | 产生的气体具有漂白性 |
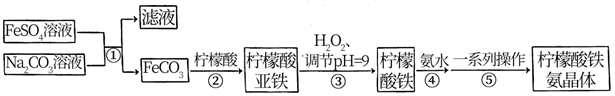 已知:
已知:  、
、  ;柠檬酸亚铁微溶于冷水,易溶于热水。
;柠檬酸亚铁微溶于冷水,易溶于热水。
下列说法正确的是( )
 C . 用向下排空气法收集一瓶干燥而纯净的氯气
D . 将盛满氯气的试管倒扣在水槽中,检测其在水中的溶解性
C . 用向下排空气法收集一瓶干燥而纯净的氯气
D . 将盛满氯气的试管倒扣在水槽中,检测其在水中的溶解性
|
选项 |
操作 |
现象 |
结论 |
|
A |
向NaHCO溶液中加入Na[Al(OH)4]溶液 |
有白色沉淀生成 |
[Al(OH)4]-结合H+的能力比CO |
|
B |
用pH试纸测定NaCl和NaF溶液的pH |
pH(NaCl)<pH(NaF) |
F元素的非金属性强于Cl |
|
C |
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 |
溶液显红色 |
Fe(NO3)2晶体已氧化变质 |
|
D |
向久置的Na2SO3溶液中加入足量BaCl2溶液,再加入足量稀盐酸 |
先出现白色沉淀后部分溶解 |
部分Na2SO3氧化变质 |
I.制备
反应原理:
实验步骤:
①称取mgNa2SO3加入仪器a中,再加入一定量的蒸馏水。另取ng研细的硫粉,用无水乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置已略去),沸水浴恒温反应60min。

③趁热过滤,将滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,得到产品。
Ⅱ.测定产品纯度
准确称取0.3g产品(杂质不参与反应),用一定量的蒸馏水溶解,用 的酸性高锰酸钾标准溶液进行滴定,发生的反应为
的酸性高锰酸钾标准溶液进行滴定,发生的反应为 。
。
回答下列问题:
-
(1) 仪器a的名称是,仪器d的进水口是(填标号)。
-
(2) Na2S2O3在酸性条件下不能稳定存在,用离子方程式表示其原因:,每生成1mol黄色固体,转移的电子数为
 。
。
-
(3) ①实验Ⅱ中滴定达到终点的标志是。
②滴定起始和終点的液面位置如图,则消耗酸性高锰酸钾标准溶液的体积为mL。

③
 产品的纯度为(保留三位有效数字)%。
产品的纯度为(保留三位有效数字)%。 -
(4)
 还原性较强,常用作脱氯剂,在溶液中易被Cl2氧化成
还原性较强,常用作脱氯剂,在溶液中易被Cl2氧化成 , 检验
, 检验 与Cl2反应后的溶液中是否存在
与Cl2反应后的溶液中是否存在 的方法为。
的方法为。

已知:Fe2+与K3[Fe(CN)6]溶液反应生成特征蓝色沉淀,Fe3+不会。
请回答:
-
(1) 铁合金在生活中应用广泛,铁合金属于(填字母)。
a.金属材料 b.高分子材料
-
(2) 写出铁和水蒸气反应的化学方程式。
-
(3) 加入足量CuSO4溶液,充分反应后过滤、洗涤的目的是(答两点)。
-
(4) 试剂A和实验现象a,试剂B和实验现象b分别是。
①加入适量氯水 ②加入足量的KMnO4溶液 ③加入少量KSCN溶液.
①向FeSO4溶液中滴加2滴K3[Fe(CN)6]溶液,产生蓝色沉淀,反应的离子方程式为:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓
②向次氯酸钙溶液中通入少量的CO2生成白色沉淀,证明Ka2(H2CO3)>Ka(HClO)
③把电石与水反应产生的气体通入酸性KMnO4溶液,紫色褪去,证明有乙炔生成
④向[Cu(NH3)4]SO4溶液中加入95%的乙醇溶液,析出深蓝色晶体,是因为溶液的极性降低,溶质的溶解度减小
 弱
弱


