第一节 钠及其化合物 知识点题库
向紫色石蕊试液中加入过量的Na2O2粉末,振荡,正确的是( )
A . 最后溶液为无色
B . 最后溶液为蓝色
C . 溶液仍为紫色
D . 最后溶液为红色
下列各组物质混合后,既产生无色气体,又生成白色沉淀的是( )
A . Ba(NO3)2溶液和Na2SO4溶液
B . 金属钠和MgCl2溶液
C . 金属铝和NaOH溶液
D . FeCl3溶液和Na2O2
向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

-
(1) 0到a点之间的反应的离子方程式
-
(2) a到b点之间的反应的离子方程式
-
(3) b点之后的反应的离子方程式
-
(4) c 点CO2的体积mL(同温同压下)。
-
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为
某兴趣活动小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4g Na2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5mL溶液a于试管中,滴入两滴酚酞 | i.溶液变红 ii.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
-
(1) Na2O2与水反应的化学方程式:。
-
(2) ii中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应。
I.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂(填化学式),有气体产生。
-
(3) II.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量:取15.mL溶液a,用稀H2SO4酸化,逐滴加入0.003 mol/L KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00mLKMnO4溶液。
①请配平: MnO4-+H2O2+ =Mn2++O2↑+H2O
②溶液a中 c(H2O2)=mol·L-1。
③溶液褪色速率开始较慢后变快的原因可能是。
-
(4) 为探究现象ii产生的原因,同学们继续进行了如下实验:
iii.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1 mol·L-1NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色。
IV.向0.1 mol·L-1NaOH溶液中滴入两滴酚酞,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2 , 溶液颜色无明显变化。
①从实验III和IV中,可得出的结论是。
28g铁粉溶于稀盐酸中,然后加入足量的Na2O2固体,充分反应后过滤,将滤渣加强热,最终得到的固体质量为( )
A . 36g
B . 40g
C . 80g
D . 160g
下列有关金属及其化合物的说法正确的是( )
A . 铝和氢氧化钠溶液反应生成Al(OH)3和Na
B . 钠在空气中燃烧生成淡黄色的NaO2
C . 铁在高温下与水蒸气反应生成Fe3O4和H2
D . 用碳酸钠和氢氧化钙反应制NaHCO3
元素及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不能通过一步反应完成的是( )
A . Na→NaOH→Na2CO3→NaCl
B . Fe→FeCl2→Fe(OH)2→Fe(OH)3
C . N2→NO→NO2→HNO3
D . H2S→S→SO3→H2SO4
完成下列填空:
-
(1) I.呼吸面具中,Na2O2起反应的化学方程式为。
-
(2) 印刷电路板由高分子材料和铜箔复合而成,用FeCl3溶液刻制印刷电路时,发生的反应离子方程式为。
-
(3) 把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度之比为3:2,则已反应的Fe3+和未反应的Fe3+的物质的量之比为。
-
(4) II.某一反应体系中有反应物和生成物共6种: HCl、H2SO4、SnCl2、SnCl4、FeSO4、Fe(SO4)3 , 反应前在溶液中滴加KSCN 溶液显红色,反应后红色消失。
该反应中的还原剂是。
-
(5) 写出该反应的化学方程式。
下列推理正确的是( )
A . 铝粉在氧气中燃烧生成Al2O3 , 故铁丝在氧气中燃烧生成Fe2O3
B . 钠与氧气、水等反应时钠作还原剂,故金属单质参与反应可作还原剂
C . 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D . 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
焰色实验过程中,铂丝的清洗和灼烧与钾焰色实验的观察两项操作如图所示,下列叙述中错误的是( )

A . 每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质
B . 钾的焰色实验要透过蓝色钴玻璃观察
C . 焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D . 没有铂丝可用无锈铁丝代替进行实验
化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
A . 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B . 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C . 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D . 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
下列实验方案能达到目的的是( )
A . 用乙醇萃取碘水中的碘单质
B . 用品红溶液鉴别SO2和CO2
C . 用NaOH溶液除去Cl2中的HCl
D . 用焰色反应鉴别NaCl和NaOH
下列关于钠及其化合物性质描述正确的是( )
A . 在Na2O2中阳离子与阴离子的个数比为2:1
B . 只有钠单质和钠盐的焰色反应呈现黄色
C . 可用石灰水区分Na2CO3与NaHCO3溶液
D . 氢氧化钠溶液具有碱性,可用于治疗胃酸过多
下列叙述中不正确的是( )
A . Na2O2 是淡黄色固体, Na2O是白色固体,二者都能与水反应生成
B . Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2O
C . Na2O 与CO2发生化合反应生成Na2CO3 , Na2O2 与CO2发生置换反应生成O2
D . 2gH2充分燃烧后产物被Na2O2完全吸收, Na2O2固体增重2 g
目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融)  2Na+Cl2↑。已知B是黄绿色气体,物质A、B、C、D、E、F有如图所示转化关系:
2Na+Cl2↑。已知B是黄绿色气体,物质A、B、C、D、E、F有如图所示转化关系:
 2Na+Cl2↑。已知B是黄绿色气体,物质A、B、C、D、E、F有如图所示转化关系:
2Na+Cl2↑。已知B是黄绿色气体,物质A、B、C、D、E、F有如图所示转化关系: 
-
(1) A→C的离子反应方程式:。
-
(2) 写出E与F反应的化学方程式:。
-
(3) A在空气中加热生成的物质的颜色为。
-
(4) B→D反应中,当消耗铁的质量112g时,此时转移的电子的物质的量为mol
-
(5) B物质还可以制备漂白粉,漂白粉的有效成分是,漂白粉若保存不当,长期露置空气中,会导致漂白作用减弱,甚至失效,其原因是(用化学方程式表示)。
A~F为中学化学常见纯净物,其中A、B的水溶液均显碱性,B是一种可用于制药的盐。C是生活中常用的一种调味品也是重要的化工原料。F的水溶液是一种强酸。它们之间的转化关系如下。(部分反应物、生成物和反应条件已略去)
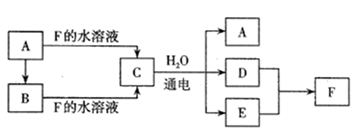
请回答下列问题:
-
(1) 写出下列物质的化学式:A,B,C,F。
-
(2) A→B的化学方程式是。
-
(3) C的溶液通电后,发生反应的离子方程式是。
化学与社会、生产、生活紧切相关。下列说法正确的是( )
A . 棉花和木材的主要成分都是纤维素,蚕丝和合成纤维的主要成分都是蛋白质
B . 石油干馏可得到石油气、汽油、煤油、柴油等
C . 从海水中提取物质都必须通过化学反应才能实现
D . 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污
下列叙述正确的是( )
A . 切开的金属钠暴露在空气中,表面会生成淡黄色的粉末
B . 钠与硫酸铜溶液反应时,有大量红色固体铜出现
C . 钠在空气中受热时,先熔化,产生黄色的火焰,生成白色粉末
D . 钠在空气中长期放置,最终主要产物为碳酸钠
一团棉花包裹少量过氧化钠放在石棉网上,将CO2气体缓缓通入棉花中的过氧化钠 上,棉花很快燃烧起来,根据实验分析可知,下列表达错误的是( )
A . CO2对棉花起助燃作用
B . 过氧化钠与CO2反应放热
C . 反应生成的O2有利于棉花燃烧
D . 过氧化钠与CO2反应固体质量增加了
下列说法错误的是( )
A . 过氧化钠与二氧化碳、水反应均生成氧气,可用于呼吸面具中的供氧剂
B . 二氧化硫能使酸性KMnO4溶液褪色,主要利用二氧化硫的漂白性
C . 二氧化氮具有较强的氧化性,可用于火箭的助燃剂
D . 由二氧化硅制得的光导纤维,其导光能力很强,可传输大量信息
最近更新



