实验活动7 化学反应速率的影响因素 知识点题库
①NO(g)+Br2(g)⇌NOBr2(g)慢
②NO(g)+NOBr2(g)⇌2NOBr(g)快
下列有关该反应的说法正确的是( )
 2NO(g),下列措施不能改变化学反应速率的是
2NO(g),下列措施不能改变化学反应速率的是
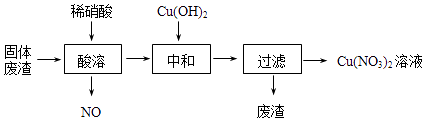
-
(1) Cu2O与稀硝酸反应的离子方程式为。
-
(2) 酸溶时,反应温度不宜超过70℃,其主要原因是,若保持反应温度为70℃,欲加快反应速率可采取的措施为(写出一种即可)。
-
(3) 过滤后所得废渣的主要成分的化学式为。
-
(4) Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2 , 该反应的化学方程式为,由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、、过滤、冰水洗涤、。
 CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( ) 
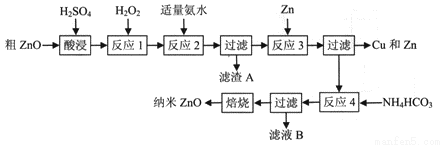
已知:① 生成氢氧化物沉淀时溶液的pH如下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
② 25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38。
请回答以以下问题:
-
(1) 酸浸时,为了提高浸出率,可采取的措施有(填写两种);
-
(2) 反应1中发生反应的离子方程式为,一种双氧水的质量分数为34.0 % (密度为1.13g/cm3) ,其浓度为mol/L;
-
(3) 反应2中加适量氨水的目的是,此时所需pH的范围为,当调节溶液pH=5时,溶液中的c(Fe3+)=;
-
(4) 反应3的离子方程式为,反应类型为;
-
(5) 从滤液B中可回收的主要物质是;
-
(6) 经检验分析,反应4 所得固体组成为Zna(OH)bCO3 , 称取该固体22.4g,焙烧后得固体16.2g,则a=。
 N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol,在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol,在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表: | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是( )
-
(1) Ⅰ.从热力学角度研究反应
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)
 SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1写出CO 还原SO2的热化学方程式:。
-
(2) 关于CO还原SO2的反应,下列说法正确的是______。A . 在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态 B . 平衡状态时,2v正(CO)=v逆(SO2) C . 其他条件不变,增大SO2的浓度,CO的平衡转化率增大 D . 在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
-
(3) Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol反应b:2C(s)+2NO2(g)
 N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min)
浓度(mol·L-1)
0
10
20
30
40
50
NO
1.00
0.58
0.40
0.40
0.48
0.48
N2
0
0.21
0.30
0.30
0.36
0.36
①0~10min内,NO的平均反应速率v(NO)=,当升高反应温度,该反应的平衡常数K(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
-
(4) ①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因;在1100kPa时,NO2的体积分数为。
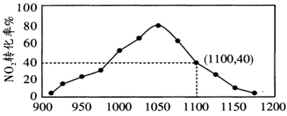
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
-
(1) Ⅰ.某实验小组对
 的分解做了如下探究。下表是该实验小组研究影响
的分解做了如下探究。下表是该实验小组研究影响  分解速率的因素时记录的一组数据,将质量相同但状态不同的
分解速率的因素时记录的一组数据,将质量相同但状态不同的  分别加入盛有
分别加入盛有 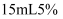 的
的  溶液的大试管中,并用带火星的木条测试,结果如下:
溶液的大试管中,并用带火星的木条测试,结果如下: MnO2
触摸试管情况
观察结果
反应完成所需的时间
粉末状
很烫
剧烈反应,带火星的木条复燃
3.5min
块状
微热
反应较慢,火星红亮但木条未复燃
30min
写出大试管中发生反应的化学方程式:,该反应是反应(填放热或吸热)。
-
(2) 实验结果表明,催化剂的催化效果与有关。
-
(3) Ⅱ.某可逆反应在体积为
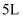 的密闭容器中进行,0~3分钟各物质的物质的量的变化情况如图所示(A、B、C均为气体)
的密闭容器中进行,0~3分钟各物质的物质的量的变化情况如图所示(A、B、C均为气体) 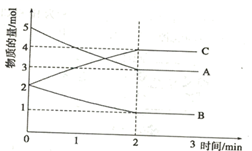
该反应的化学方程式为。
-
(4) 反应开始至2分钟末,用B的浓度变化表示的反应速率为。
-
(5) 能说明该反应已达到平衡状态的是_____(填字母符号)。A .
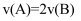 B . 容器内压强保持不变
C .
B . 容器内压强保持不变
C .  D . 容器内混合气体的密度保持不变
D . 容器内混合气体的密度保持不变
-
(6) 在密闭容器里,通入
 ,发生上述反应,当改变下列条件时,反应速率会减小的是________(填字母符号)。
A . 降低温度 B . 加入催化剂 C . 增大容器体积
,发生上述反应,当改变下列条件时,反应速率会减小的是________(填字母符号)。
A . 降低温度 B . 加入催化剂 C . 增大容器体积
| 选项 | 事实 | 结论 |
| A. | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B. | 工业制硫酸过程中,在SO3的吸收阶段,喷洒浓硫酸吸收SO3 | 增大气液接触面积,使SO3的吸收速率增大 |
| C. | 在容积不变的密闭容器中发生反应: | 反应速率减慢 |
| D. | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
 2NH3(g)ΔH<0。下列说法正确的是( )
2NH3(g)ΔH<0。下列说法正确的是( )
-
(1) I.已知Na2S2O3与硫酸的反应为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某研究小组为研究外界条件对化学反应速率的影响,设计实验如下,请回答下列问题。
根据“控制变量”的原则,实验①②研究的是对化学反应速率的影响。实验序号 反应温度 加入0.1mol/LNa2S2O3溶液 加入0.1mol/LH2SO4溶液 加入水的体积 出现浑浊的时间 ① 20℃ 2mL 2mL 0 t1s ② 40℃ 2mL V1mL 0 t2s ③ 20℃ 1mL 2mL V2mL t3s -
(2) V2=。
-
(3) t1、t2、t3由大到小的顺序是。
-
(4) II.炼铁高炉中存在可逆反应Fe(s)+CO2(g)⇌FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。

t1时,正反应速率(填“>“”<”或“=”)逆反应速率。
-
(5) 0~4min时间段内,v(CO)=mol·L-1·min-1。反应达最大限度时,体系内混合气体的平均相对分子质量是(计算结果精确到0.1)。
-
(6) 下列条件的改变能减慢其反应速率的是。
a.降低温度
b.减少铁粉的质量
c.保持压强不变,充入He使容器的体积增大
d.保持体积不变,充入He使体系压强增大
 2SO3(g) ΔH=xkJ·mol–1 , 不同条件下反应过程能量变化如图所示。下列说法中错误的是( )
2SO3(g) ΔH=xkJ·mol–1 , 不同条件下反应过程能量变化如图所示。下列说法中错误的是( )
 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是( )
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是( )

-
(1) 反应
CaSO4与足量的NH3和CO2的混合原料气反应生成(NH4)2SO4。
①工业上在通入NH3和CO2的混合原料气发生反应前,常先将CaSO4固体粉碎,加水配成CaSO4浊液,目的是。
②为提高产品(NH4)2SO4的纯度,反应时应控制原料气中氨气和二氧化碳的体积之比
 =(填“2:1”、“1:1”或“1:2”)。
=(填“2:1”、“1:1”或“1:2”)。 -
(2) 过滤
将反应所得混合物过滤得到主要成分为硫酸铵的滤液,滤渣为CaCO3。
①实验室进行过滤操作时,使用玻璃棒的作用是。
②煅烧过滤所得的滤渣可得到副产品CaO,该反应的△H0(填“>”、“=”或“<”)。
-
(3) 结晶滤液经结晶、过滤、洗涤、低温烘干后,得到产品硫酸铵晶体。
①结晶时应选用的实验操作是(填“蒸发结晶”或“蒸发浓缩、降温结晶”)。
②为进一步测定实验获得的(NH4)2SO4晶体中的含氮量,进行了以下实验:
准确称取2.8000g样品加入足量的NaOH溶液并充分加热,生成224.00mLNH3(标准状况),计算该产品中N元素的质量分数(写出计算过程)。
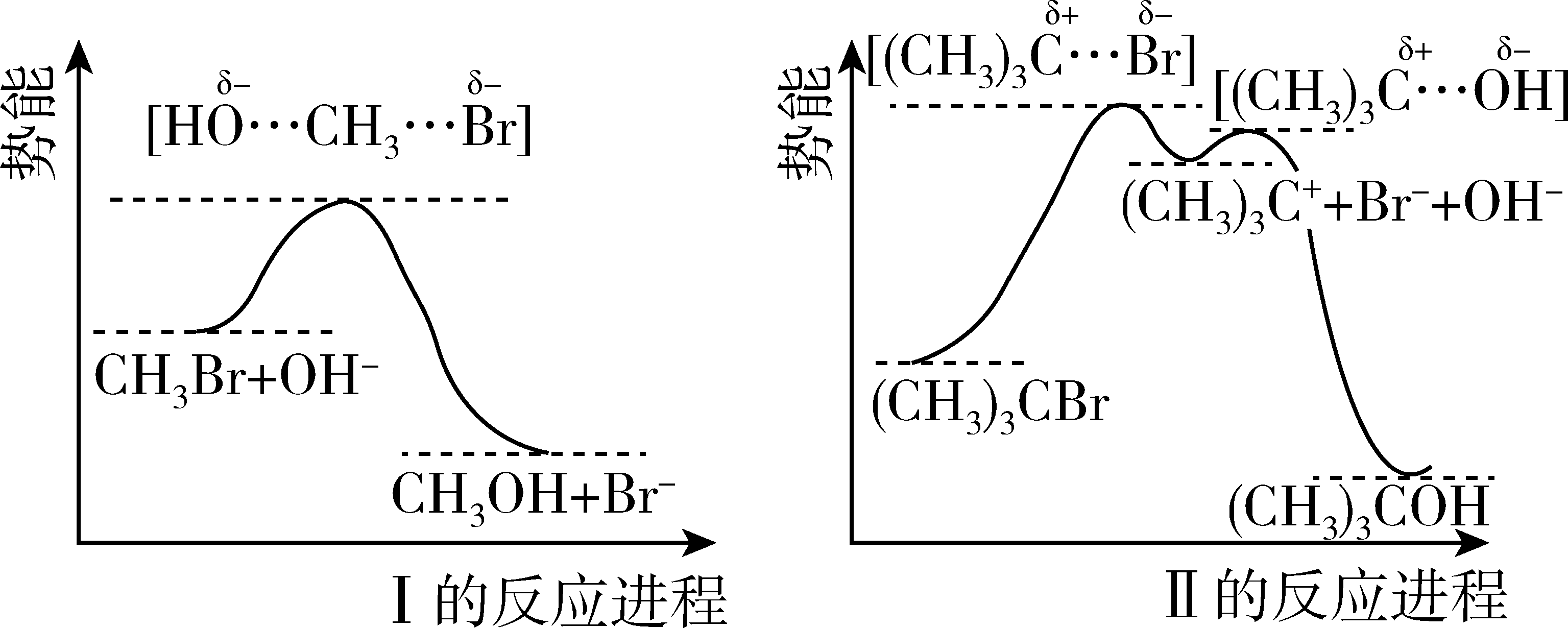
I.CH3Br+NaOH→CH3OH+NaBr
II.(CH3)3CBr+NaOH→(CH3)3COH+NaBr
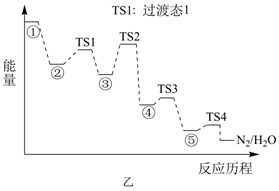
 的催化剂可用于汽车尾气脱硝。催化机理如图甲,反应历程如图乙。下列说法正确的是( )
的催化剂可用于汽车尾气脱硝。催化机理如图甲,反应历程如图乙。下列说法正确的是( ) 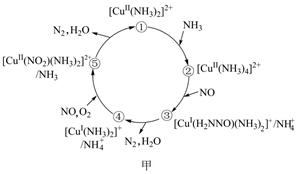
 可加快脱硝速率,提高脱硝的平衡转化率
B . 状态③到状态④的变化过程为图示反应的决速步骤
C . 升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度
D . 当有
可加快脱硝速率,提高脱硝的平衡转化率
B . 状态③到状态④的变化过程为图示反应的决速步骤
C . 升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度
D . 当有  消耗时,状态④到状态⑤的变化过程中转移的电子为
消耗时,状态④到状态⑤的变化过程中转移的电子为 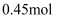
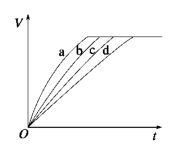
组别 | 对应曲线 | c(HCl)/mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a | 30 | 粉末状 | |
2 | b | 30 | 粉末状 | |
3 | c | 2.5 | 块状 | |
4 | d | 2.5 | 30 | 块状 |
 ,向其中通入氩气
,向其中通入氩气


