第一章 化学反应的热效应 知识点题库
序号 | 液体 | 固体 | 混合前温度 | 混合后最高温度 |
① | 35mL水 | 2.5g NaHCO3 | 20℃ | 18.5℃ |
② | 35mL水 | 3.2g Na2CO3 | 20℃ | 24.3℃ |
③ | 35mL盐酸 | 2.5g NaHCO3 | 20℃ | 16.2℃ |
④ | 35mL盐酸 | 3.2g Na2CO3 | 20℃ | 25.1℃ |
H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1下列结论正确的是( )
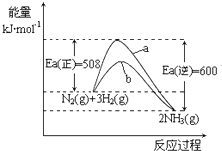
-
(1) Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)═MgH2(s)△H1=﹣74.5kJ•mol﹣1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=﹣64.4kJ•mol﹣1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
则△H3=kJ•mol﹣1 .
-
(2) 工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2•6H2O转化为MgCl2•NH4Cl•nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为;电解熔融氯化镁,阴极的电极反应式为
-
(3) 储氢材料Mg(AlH4)2在110﹣200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑每生成27gAl转移电子的物质的量为.
①4Al(s)+3O2(g)=2Al2O3(s) ΔH=−2 834.9 kJ·mol−1
②4Al(s)+2O3(g)=2Al2O3(s) ΔH=−3 119.1 kJ·mol−1
由此得出的正确结论是( )

 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:

-
(1) 图中A、C分别表示: 、,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是 。
-
(2) 图中ΔH=kJ/mol。
-
(3) 已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成2 mol SO3(g)ΔH=
 2Ag(s)+1/2O2(g)=Ag2O(s)ΔH=﹣31.0 kJ·
2Ag(s)+1/2O2(g)=Ag2O(s)ΔH=﹣31.0 kJ· 
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的ΔH等于( )
 B . ﹣379.3 kJ·
B . ﹣379.3 kJ·  C . ﹣332.8 kJ·
C . ﹣332.8 kJ·  D . +317.3 kJ·
D . +317.3 kJ· 
Sabatior反应:CO2(g)+4H2(g)  CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(g)  2H2(g)+O2(g)
2H2(g)+O2(g)
-
(1) 将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

①请将a、b、c三点的逆反应速率va、vb、vc由大到小排序:。
②Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原科气中CO2所占比例
E.合理控制反应器中气体的流速
③高于380℃,H2O的物质的量分数随温度升高而降低的原因是:。
-
(2) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)
 C(s)+2H2O(g) △H代替Sabatier反应,再电解水实现O2的循环利用。
C(s)+2H2O(g) △H代替Sabatier反应,再电解水实现O2的循环利用。 Ⅰ.①已知:CO2(g)和H2O(g)的生成焓为:-394kJ/mol,-242kJ/mol。则△H=kJ/mol。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热。)
②若要此反应自发进行(填“高温”或“低温”)更有利。
③Bosch反应必须在高温下才能启动,原因是。
Ⅱ.350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
时间/min
0
10
20
30
40
50
60
压强
6.00P
5.60P
5.30P
5.15P
5.06P
5.00P
5.00P
①350℃时Bosch反应的Kp=(Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
②Bosch反应的速率方程:v正=k正•c(CO2)•c2(H2),v逆=k逆•c2(H2O)(k是速率常数,只与温度有关)。30min时,

 (填“>”“<”或“=”);升高温度,k正增大的倍数k逆增大的倍数。(填“>”“<”或“=”)
(填“>”“<”或“=”);升高温度,k正增大的倍数k逆增大的倍数。(填“>”“<”或“=”)

-
(1) 从如图实验装置可知,缺少的一种仪器名称是。
-
(2) 若改用60 mL 0.25 mol·L−1 H2SO4和50 mL 0.55 mol·L−1 NaOH溶液进行反应,则比上述实验所放出的热量(填“多”或“少”),若实验操作均正确,最少需要测定次温度。
-
(3) 写出用稀H2SO4和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol−1):。
-
(4) 某学生实验记录数据如下:
实验
起始温度t1/℃
终止温度t2/℃
序号
硫酸
氢氧化钠溶液
混合溶液
1
20.0
20.2
23.2
2
20.2
20.4
23.4
3
20.4
20.6
23.6
依据该学生的实验数据计算,该实验测得的中和热ΔH=(结果保留一位小数)(已知稀溶液的比热容为4.18J/(g·℃),稀溶液的密度1g/cm3)。
-
(5) 上述实验数值结果与57.3kJ·mol−1有偏差,产生偏差的原因可能是。
a.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度 b.量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中 d.实验装置保温、隔热效果差
-
(1) 在 25℃、101 kPa 时,1.0 g C8H18(l,辛烷)燃烧生成CO2(g)和H2O(l),放出48.40kJ的热量,则C8H18(l)的燃烧热为kJ/mol
-
(2) 已知N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,N2H4(g)+O2(g)= N2(g)+2H2O (g) ΔH=-534kJ/mol,根据盖斯定律写出肼(N2H4)与 NO2完全反应生成氮气和气态水的热化学方程式。
-
(3) 某反应过程中的能量变化如图所示,则该反应是反应(填“放热”或“吸热”),判断依据是。
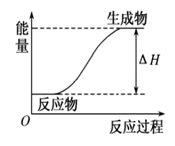
-
(4) 已知:2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJ•mol-1
N2(g)
 2N(g)
2N(g)Cl2(g)
 2Cl(g)
2Cl(g)则断开1 mol H–N键与断开1 mol H-Cl键所需能量相差约为kJ。

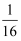 CH4 (g)+
CH4 (g)+ 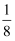 O2 (g) =
O2 (g) = 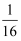 CO2 (g)+
CO2 (g)+ 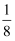 H2O(g) △H= -55.6 kJ·mol- 1
C . CH4 (g) + 2O2 (g) =CO2 (g) + 2H2O (l) △H= -889.6 kJ·mol- 1
D . CH4 (g) +2O2 (g) = CO2 (g) + 2H2O (l) △H= +889.6 kJ·mol- 1
H2O(g) △H= -55.6 kJ·mol- 1
C . CH4 (g) + 2O2 (g) =CO2 (g) + 2H2O (l) △H= -889.6 kJ·mol- 1
D . CH4 (g) +2O2 (g) = CO2 (g) + 2H2O (l) △H= +889.6 kJ·mol- 1

 +2H++e-=VO2++H2O
+2H++e-=VO2++H2O
Ⅰ.CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
Ⅱ.2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
Ⅲ.CO2(g)+H2(g)  CO(g)+H2(g) ΔH3
CO(g)+H2(g) ΔH3
Ⅳ.2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g) ΔH4
CH3OCH3(g)+3H2O(g) ΔH4
回答下列问题:
-
(1) ΔH4=kJ·mol-1。
-
(2) 体系自由能变ΔG=ΔH-TΔS , ΔG<0时反应能自发进行。反应Ⅰ、Ⅱ、Ⅲ的自由能变与温度的关系如图a所示,在298~998K下均能自发进行的反应为(填“Ⅰ”“Ⅱ”或“Ⅲ”)。

-
(3) 在三个完全相同的恒容密闭容器中,起始时均通入3molH2和1molCO2 , 分别只发生反应Ⅰ、Ⅲ、Ⅳ时,CO2的平衡转化率与温度的关系如图b所示。
①ΔH30(填“>”或“<”)。
②反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为p(CO2)pMPa(精确到0.01)。
③在B点对应温度下, K(Ⅰ)(填“大于”“小于”或“等于”)K(Ⅲ)。
-
(4) 向一体积为1L的密闭容器中通入H2和CO2 , 只发生反应Ⅳ。CO2的平衡转化率与压强、温度及氢碳比m[m=
 ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。 
①图c中压强从大到小的顺序为,图d中氢碳比m从大到小的顺序为。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2 , CO2的平衡转化率为50%,则在此温度下该反应的平衡常数K=(保留整数)。
 , 反应产物中的S实为
, 反应产物中的S实为 , 它是一个八元环状分子(即
, 它是一个八元环状分子(即 ),
), 中可看成含2个
中可看成含2个 键。部分共价键键能的数据如下:
键。部分共价键键能的数据如下: :
: ;
; :
: ;
; :
: ;
; :
: 。则a为( )
。则a为( )
 B .
B .  C .
C .  D .
D . 

 与稀
与稀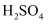 反应
B . 氢气与氮气的化合反应
C . 灼热的炭与
反应
B . 氢气与氮气的化合反应
C . 灼热的炭与 反应
D .
反应
D .  晶体与
晶体与 晶体反应
晶体反应



