第二章 化学反应速率与化学平衡 知识点题库
 3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )
3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( ) 
-
(1) (一) 现代铝的精炼研究方向是减低能耗。如图 :室温下通过电解在阴极沉积纯铝,AlBr3 在苯(简写 ArH)中可以生成[Al2Br5ArH]+和 Br-。

阳极的材料;
-
(2) 写出阴极沉积铝的电极方程式;
-
(3) (二)邻硝基苯甲酸是重要的医院中间体,最新合成方法是邻硝基甲苯和高锰酸钾在相转移催化剂季铵盐(Q+X-)氧化、酸化合成,其原理如下:

相转移催化原理如下:

有关物质的物理性质如下表:
物质
邻硝基苯甲酸
高锰酸钾
苄基三乙基氯化铵(C6H5-CH2CH2)N(C2H5)3Cl
聚乙二醇

四丁基溴化铵(C4H9)4NBr
NH4Cl
水
难溶
易溶
可溶
任意比互溶溶
可溶
易溶
有机物
易溶
难溶
易溶
易溶
易溶
难溶
下列说法不合理的是________;
A . 相转移催化剂作用主要决定于 Q+的物理化学性质 B . 反应中为了防止温度剧烈升高,投料应该分批加入 C . Q+X-是通过增大反应接触面积提高反应速率 D . 增大压强可以提高邻硝基甲苯氧化的反应限度 E . 工业使用季铵盐(Q+X-)可以提高邻硝基苯甲酸产率 -
(4) 四丁基溴化铵(C4H9)4NBr 萃取水中的高锰酸钾的方程式为:KMnO4(aq) +Q+X-(aq) →Q+ MnO4- (aq) +KX(aq) , 写出平衡常数 k 的表达式;设n(Q+X-):n(邻硝基甲苯)=x,理论证明当 x=5%邻硝基甲酸产率 y 得到最大值,请画出 y 随 x 变化的示意图 。
-
(5) 实验表明,当温度 100℃、反应时间 2.5h,n(KMnO4): n(邻硝基甲苯)=3:1,催化剂用量相同,Q+X-反应的催化效果如下:
相转移催化剂
苄基三乙基氯化铵
(C6H5-CH2CH2)
N(C2H5)3Cl
聚乙二醇

四丁基溴化铵
(C4H9)4NBr
产率%
46.7
20.0
53.1
苄基三乙基氯化铵比四丁基溴化铵催化效果差的原因;工业生产不用聚乙二醇做催化剂的主要原因 ;
-
(6) (C4H9)4NBr 为催化剂,邻硝基甲苯和高锰酸钾反应,测得溶液酸碱性对产率、反应时间影响如图 ,下列推测合理的是________。
 A . 溶液碱性强产率降低是因为季铵盐发生水解反应 B . pH=2 高锰酸钾一定发生副反应 C . 选择 pH=7、适当升温可以提高产率 D . 工业可以选择浓硝酸替代高锰酸钾做氧化剂,减缓对设备的腐蚀
A . 溶液碱性强产率降低是因为季铵盐发生水解反应 B . pH=2 高锰酸钾一定发生副反应 C . 选择 pH=7、适当升温可以提高产率 D . 工业可以选择浓硝酸替代高锰酸钾做氧化剂,减缓对设备的腐蚀
 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( ) 
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
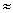
 mol/(L·min)
B . 6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
B . 6~10min的平均反应速率:v(H2O2)<  mol/(L·min)
C . 反应至6min时,c(H2O2)=0.3mol/L
D . 反应至6min时,H2O2分解了50%
mol/(L·min)
C . 反应至6min时,c(H2O2)=0.3mol/L
D . 反应至6min时,H2O2分解了50%
-
(1) CH3OH和液氧是常用的液体火箭推进剂。
①已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(l) ΔH1
2H2(g)+O2(l)=2H2O(l) ΔH2
CH3OH(g)=CH3OH(l) ΔH3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l) ΔH4
则ΔH4=(用ΔH1、ΔH2、ΔH3来表示)。
②某温度下,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1molCH3OH和1molH2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数(保留四位有效数字)。保持其他条件不变,在第5min时向体系中再充入0.2molCO2和0.4molH2 , 第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图1中画出5~9min的c(CO2)变化曲线示意图。
-
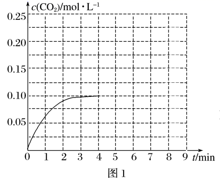
(2) NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3 , 其工作原理如图2所示,A电极的名称为极,请写出在B电极上发生的电极反应式:。


 CO2+H2在800℃达到平衡时分别改变下列条件,K值发生变化的是( )
CO2+H2在800℃达到平衡时分别改变下列条件,K值发生变化的是( )
-
(1) Ⅰ.用CO2生产甲醇
已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l)ΔH=-37.3kJ/mol
则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(l)ΔH=kJ/mol。
-
(2) 将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。

a,b两点化学反应速率分别用
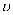 a、
a、 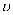 b表示,则
b表示,则 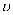 a
a 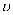 b(填“>”、“<”或“=”)。
b(填“>”、“<”或“=”)。 -
(3) 在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:

下列说法正确的是________。
A . 该反应的正反应为放热反应 B . 压强大小关系为p1<p2<p3 C . M点对应的平衡常数K的值约为1.04×10-2 D . 在p2及512K时,图中N点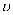 (正)<
(正)< 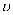 (逆)
(逆)
-
(4) Ⅱ.用CO生产甲醇
已知:CO(g)+2H2(g)⇌CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

T1和T2温度下的平衡常数大小关系是K1K2(填“>”、“<”或“=”)。
-
(5) Ⅲ.甲醇的应用
甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1 , 反应达到平衡时总压强为p2 , 则平衡时甲醇的转化率为。
 增大
D . 加入0.1mol•L-1CH3COONa溶液使pH=7,则c(CH3COO-)=c(Na+)
增大
D . 加入0.1mol•L-1CH3COONa溶液使pH=7,则c(CH3COO-)=c(Na+)
-
(1) 已知:H2S的燃烧热△H1=-586kJ/mol;硫的燃烧热△H2=-297kJ/mol。25℃、101kPa时,1molH2S不完全燃烧生成固态S和液态H2O的反应热△H3=kJ/mol
-
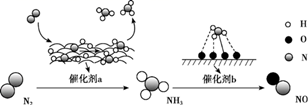
(2) SO2催化氧化制SO3 , 是重要化工反应。该反应用V2O5 , 作为催化剂,催化反应过程如下图所示。该反应加入催化剂后正反应的活化能为。加入催化剂能提高该反应的化学反应速率的原因是。

-
(3) 工业上在接触室中用SO2与空气中O2反应制取SO3.原料气中各成分的体积分数为:SO2~7%,O2~11%,氮气~82%时,温度及压强对SO2平衡转化率的影响如下表所示。

0.1
0.5
1
10
400
99.2
99.6
99.7
99.9
500
93.5
96.6
97.8
99.3
600
73.7
85.8
89.5
96.4
从表中数据分析,工业上采取400℃~500℃、1MPa条件下合成SO3的原因是。在T℃、1MPa条件下,SO2的平衡转化率为x,压强平衡常数Kp=(写出计算式即可)。(以分压代替物质的量浓度,分压=总压×物质的量分数)。
-
(4) 锂—硫电池是重要的新型储能可逆电池,其构造如图所示。

电池充电时,与电源负极所连电极发生的电极反应为,在电池放电时,电池右边电极依次发生Li2S8→Li2S6→Li2S4→Li2S2→Li2S系列转化。若放电前,图右边电极中Li2Sx只有Li2S8 , 放电后生成产物Li2S、Li2S2物质的量之比为6:1,则1mol Li2S8反应得到的电子数为。
 常被称为绿色氧化剂。
常被称为绿色氧化剂。
-
(1)
 电子式是。
电子式是。
-
(2) 为分析
 对
对  分解反应的催化效果,某同学做了以下实验。
分解反应的催化效果,某同学做了以下实验。 实验ⅰ.向
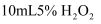 溶液中滴加5滴
溶液中滴加5滴  溶液,较快产生无色无味气体。
溶液,较快产生无色无味气体。实验ⅱ.向
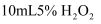 溶液中滴加5滴
溶液中滴加5滴  溶液,无气体产生。
溶液,无气体产生。由此推断
 对
对  分解反应有催化作用,实验i中发生反应的离子方程式为:a.;b.
分解反应有催化作用,实验i中发生反应的离子方程式为:a.;b. 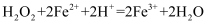 。实验ⅱ的目的是:。
。实验ⅱ的目的是:。 -
(3) 硏究表明:过氧化氢溶液中
 的浓度越大,过氧化氢的分解速率越快。
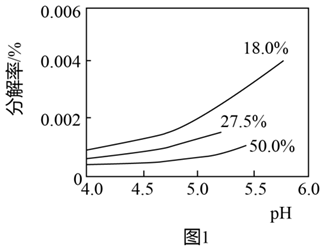
的浓度越大,过氧化氢的分解速率越快。 常温下,不同浓度的过氧化氢分解率与pH的关系如图1所示。
已知:
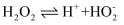 ,
, 
①一定条件下,相同时间内
 分解率随溶液
分解率随溶液  增大而增大的原因是:。
增大而增大的原因是:。②相同
 下,过氧化氢浓度越大分解速率越快,但是相同时间内
下,过氧化氢浓度越大分解速率越快,但是相同时间内  分解率反而降低,分析其原因。
分解率反而降低,分析其原因。 -
(4)
 常用来腐蚀金属铜,使用时加入盐酸或氨水将其配制成酸性或碱性腐蚀液。
常用来腐蚀金属铜,使用时加入盐酸或氨水将其配制成酸性或碱性腐蚀液。 ①酸性条件下
 腐蚀金属铜的离子方程式为。
腐蚀金属铜的离子方程式为。②图2是研究碱性腐蚀液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因。
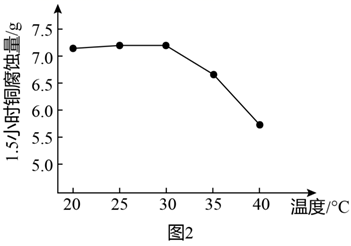

①N2(g)+3H2(g)  2NH3(g)
2NH3(g)
②N2(g)+O2(g)  2NO(g)
2NO(g)
根据图中的数据判断下列说法正确的是( )
-
(1) 某科学小组在973K下用CO还原过量的FeO,平衡时CO的体积分数为0.5951,相同温度下H2还原过量FeO,平衡时H2的体积分数为0.7024。根据上述实验结果判断,还原FeO(s)为Fe(s)的倾向是COH2(填“大于”或“小于”)。
-
(2) 973K时,在密闭容器中将等物质的量的CO2和H2混合,发生反应CO2(g)+H2(g)=CO(g)+H2O(g),采用甲作催化剂进行反应,则平衡时体系中H2的转化率50%(填“大于”、“等于”或“小于”)。
-
(3) 已知1173K时,反应CO2(g)+H2(g)
 COg)+H2O(g) K=1.29,如图,在密闭容器冲入等物质的量的CO2和H2混合,分别使用催化剂甲、催化剂乙在不同温度下反应一段时间测得H2的转化率与温度的关系,下列说法正确的是___。
COg)+H2O(g) K=1.29,如图,在密闭容器冲入等物质的量的CO2和H2混合,分别使用催化剂甲、催化剂乙在不同温度下反应一段时间测得H2的转化率与温度的关系,下列说法正确的是___。  A . va(逆)<va(正) B . a点平衡转化率大于b点平衡转化率 C . d点反应处于逆行进行中 D . e点后转化率下降,可能是温度升高催化剂失去活性
A . va(逆)<va(正) B . a点平衡转化率大于b点平衡转化率 C . d点反应处于逆行进行中 D . e点后转化率下降,可能是温度升高催化剂失去活性 -
(4) 以CO、H2和CO2制备甲醇
①CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2则△H1△H2(填“大于”、“等于”或“小于”)。已知CO可使反应的催化剂寿命下降,工业上用氢碳比表示反应物利用率,氢碳比=
 ,则理论上氢碳比=时,原料气的利用率最高,但生产中住往采用略高于该值的氢碳比,理由是。
,则理论上氢碳比=时,原料气的利用率最高,但生产中住往采用略高于该值的氢碳比,理由是。 -
(5) CO和CO2也可相互转化。向某体积可变的恒压密闭容器(p)加入1molCO2与足量的碳,发生反应C(s)+CO2(g)
 2CO(g),平衡时体系中气体体积分数与温度的关系如图1所示。则925℃时压强平衡常数K2是T℃压强平衡常数K1的倍;在不同温度下,平衡时体系中CO2体积分数与压强的关系如图2所示,则保持D点容器体积不变,降低温度,达到新的平衡点可能是图2中A—G中的点。
2CO(g),平衡时体系中气体体积分数与温度的关系如图1所示。则925℃时压强平衡常数K2是T℃压强平衡常数K1的倍;在不同温度下,平衡时体系中CO2体积分数与压强的关系如图2所示,则保持D点容器体积不变,降低温度,达到新的平衡点可能是图2中A—G中的点。 
 H++CN- , 平衡常数为Ka。现对HCN溶液做如下处理,其中叙述正确的是( )
H++CN- , 平衡常数为Ka。现对HCN溶液做如下处理,其中叙述正确的是( )
 H2S(g)+2H2O(g) △H<0。部分物质的物质的量n(X)随时间t变化如图中实线所示。下列说法正确的是( )
H2S(g)+2H2O(g) △H<0。部分物质的物质的量n(X)随时间t变化如图中实线所示。下列说法正确的是( )
 L•mol-1
D . 若该反应在T2℃(T2<T1)时进行,则虚线b可表示n(SO2)的变化
L•mol-1
D . 若该反应在T2℃(T2<T1)时进行,则虚线b可表示n(SO2)的变化

 , 该反应的平衡常数增大
C . 若断开1molH-Cl键的阿时有1molH-O键断开,则表明该反应达到平衡状态
D . 该反应的平衡常数表达式
, 该反应的平衡常数增大
C . 若断开1molH-Cl键的阿时有1molH-O键断开,则表明该反应达到平衡状态
D . 该反应的平衡常数表达式



