第三节 化学反应的方向 知识点题库
2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2 , 引起了各国的普遍重视.过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ•mol﹣1)的变化:


-
(1) 关于该反应的下列说法中,正确的是 (填字母).
A . △H>0,△S>0 B . △H>0,△S<0 C . △H<0,△S<0 D . △H<0,△S>0 -
(2) 为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)=.
②该反应的平衡常数表达式K= .
③下列措施中能使化学平衡向正反应方向移动的是(填字母).
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入1molCO2和3molH2
-
(3) 25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,写出该反应的热化学方程式:.
CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明容器内反应达到平衡状态的是
A.混合气体的平均相对分子质量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变.
-
(1) 该反应(填“能”或“不能”)自发进行;
-
(2) 据本题反应数据分析,温度(填“能”或“否”)成为反应方向的决定因素;
-
(3) 若温度能决定反应方向,则该反应自发进行的最低温度为.
-
(4) 反应 CH3OH(l)+NH3(g)=CH3NH2(g)+H2O(g)在高温下自发向右进行,若反应|△H|=17KJ•mol﹣1 , |△H﹣T△S|=17KJ•mol﹣1 , 则下列判断正确的是
A﹒△H>0△H﹣T△S<0B﹒△H<0△H﹣T△S>0
C﹒△H>0△H﹣T△S>0D﹒△H<0△H﹣T△S<0.
 Cl2(g)=AgCl(s) ΔH=-127 kJ·mol-1
C . H2O2(l)=
Cl2(g)=AgCl(s) ΔH=-127 kJ·mol-1
C . H2O2(l)=  O2(g)+H2O(l) ΔH=-98 kJ·mol-1
D . HgO(s)=Hg(l)+
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
D . HgO(s)=Hg(l)+  O2(g) ΔH=+91 kJ·mol-1
O2(g) ΔH=+91 kJ·mol-1
-
(1) 关于反应H2(g)+1/2O2(g)=H2O(l),下列说法错误的是________。A . 焓变ΔH<0,熵变ΔS<0 B . 可以把反应设计成原电池,实现能量的转化 C . 一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行 D . 选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
-
(2) ①根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O-H…O)。
②将一定量水放入抽空的恒容密闭容器中,测定不同温度(T)下气态、液态水平衡共存[H2O(l)H2O(g)]时的压强(p)。在图中画出从20℃开始经过100℃的p随T变化关系示意图(20℃时的平衡压强用p1表示)。


-
(3) 水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1 MPa)时的水称为超临界水。
①与常温常压的水相比,高温高压液态水的离子积会显著增大。解释其原因。
②如果水的离子积Kw从1.0×10−14增大到1.0×10−10 , 则相应的电离度是原来的倍。
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计的物质的量分数,t为反应时间。


下列说法合理的是。
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件下,反应时间大于15 s时,乙醇氧化为二氧化碳已趋于完全
C.乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D.随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
-
(4) 以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8 , 再与水反应得到H2O2 , 其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是。
②制备H2O2的总反应方程式是。
 C,在低温下能自发进行,在高温下不能自发进行,对该反应过程ΔH、ΔS的判断正确的是( )
C,在低温下能自发进行,在高温下不能自发进行,对该反应过程ΔH、ΔS的判断正确的是( )
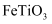 )和金红石(
)和金红石(  )。
)。
-
(1) Ⅰ.图为一种由钛铁矿(
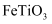 )制取钛和副产物
)制取钛和副产物 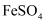 晶体的工艺流程:
晶体的工艺流程: 
为了提高磁选效率,可采取的措施为。
-
(2) 流程中加入铁的作用为。
-
(3) 流程中可以循环使用的物质是(填化学式)。
-
(4) Ⅱ.图1流程较为复杂,目前大规模生产钛采用氯化法,即将钛铁矿与焦炭混合,通入氯气并加热制得
 ,将
,将  蒸馏出来并提纯后,在氩气保护下与镁在
蒸馏出来并提纯后,在氩气保护下与镁在  下共热制得钛。流程为图2:
下共热制得钛。流程为图2: 
熔炼过程中反应的化学方程式为,熔炼过程中发生的反应为吸热反应,该反应能够自发进行的原因是。
Ⅲ.从
 获得单质钛也可以采用熔盐电解法,“熔盐电解法”被认为是最可能全面代替“金属热还原法”的工艺。FFC-熔盐电脱氧法的具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下(熔盐不分解)电解,阴极生成金属钛。
获得单质钛也可以采用熔盐电解法,“熔盐电解法”被认为是最可能全面代替“金属热还原法”的工艺。FFC-熔盐电脱氧法的具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下(熔盐不分解)电解,阴极生成金属钛。 -
(5) 写出阴极的电极反应式:,电解时要控制电压不能太高的原因是。
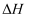 <0同时
<0同时 <0的反应在低温下能自发进行
B .
<0的反应在低温下能自发进行
B . 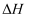 >0同时
>0同时 >0的反应在任何温度下均不能自发进行
C . 已知
>0的反应在任何温度下均不能自发进行
C . 已知 ,
,  , 则
, 则 >
> D . 已知
D . 已知 ,
,  , 则
, 则 >
>
-
(1) 我国研究人员研发了一种新型纳米催化剂,实现CO2和H2反应得到CH4 , 部分微粒转化过程如图所示(吸附在催化剂表面上的物种用*标注)。过程②
 0(填“>”“=”或“<”);过程④的化学方程式为。
0(填“>”“=”或“<”);过程④的化学方程式为。
-
(2) 已知甲烷隔绝空气可能发生如下裂解反应:

 。该反应属于(填“高温”或“低温”)自发反应。该反应自发进行是由(填“焓变”或“熵变”)决定的。
。该反应属于(填“高温”或“低温”)自发反应。该反应自发进行是由(填“焓变”或“熵变”)决定的。
-
(3) 为解决气候危机,我国制定了实现“碳中和”和“温室气体净零排放”的长期战略目标。减少1t甲烷排放相当于减少25t二氧化碳排放。CH4-CO2催化重整制备合成气的反应过程如图所示[C(ads)为吸附性活性炭,E表示方框中物质的总能量(单位:
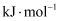 ),TS表示过渡态。]
),TS表示过渡态。]
①CH4-CO2 , 催化重整总反应的热化学方程式为。
②某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为。
-
(1) 工业生产氯化物通常用由氧化物经氯化作用生成的方法,例如工业上常采用“加碳氯化”的方法以高钛渣(主要成分为
 )为原料生产
)为原料生产 。
。已知:

 ;
;
 。
。沸腾炉中“加碳氯化”生成
 和
和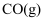 的热化学方程式:。
的热化学方程式:。 -
(2)
 合成有机物时会产生副产物
合成有机物时会产生副产物 。利用反应
。利用反应 可实现氯的循环利用。
可实现氯的循环利用。①该反应的
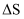 0(填“>”“<”或“=”)。
0(填“>”“<”或“=”)。②若反应物按物质的量
 (
( )在体积不变的密闭容器中发生该反应,下列叙述正确的是(填字母)。
)在体积不变的密闭容器中发生该反应,下列叙述正确的是(填字母)。A.当
 不变时,说明反应已达到平衡状态
不变时,说明反应已达到平衡状态B.当
 时,说明反应已达到平衡状态
时,说明反应已达到平衡状态C.平衡后,继续按
 的物质的量之比投入
的物质的量之比投入 和
和 , 再次达到新平衡时,
, 再次达到新平衡时, 的转化率增大
的转化率增大D.平衡后,分离出
 , 可以提高
, 可以提高 的平衡产率,并加快正反应速率
的平衡产率,并加快正反应速率③下图是在两个不同温度
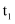 和
和 下,改变
下,改变 时
时 在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是(填字母)。
在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是(填字母)。
A.a点未达到平衡,c点一定已经平衡
B.平衡常数:

C.达到平衡时
 的转化率大小为a>b>c
的转化率大小为a>b>cD.若平衡常数K值变大,达新平衡前
 始终减小
始终减小 -
(3) 在一定温度下,以
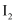 为催化剂,氯苯(
为催化剂,氯苯( )和
)和 在
在 中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:
中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:i.

ii.

向盛有
 含有
含有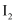 的
的 的容器中加入
的容器中加入 和
和 发生反应,忽略
发生反应,忽略 溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
①该温度下,反应ii的化学平衡常数
 。
。②工业生产上,提高生成邻二氯苯(A)反应选择性的关键因素是选择合适的。



