第四节 沉淀溶解平衡 知识点题库

-
(1) 从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为.
-
(2) 浸取过程中Fe2(SO4)3的作用是,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为.
-
(3) 除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为.该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是.
-
(4) 置换法除重金属离子是Cd2+ , 所用物质C为.
-
(5) 硫酸锌的溶解度与温度之间的关系如下表:
温度/℃
0
20
40
60
80
100
溶解度/g
41.8
54.1
70.4
74.8
67.2
60.5
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、过滤、干燥.

注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
-
(1) “除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=时,除镍效果最好。
加NH3·H2O调pH
收率/%
Ni2+含量/%
9
98.1
0.08
9.5
98
0.05
10
97.6
0.005
10.3
94
0.005
-
(2) “除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3 , 此反应的化学方程式为。
-
(3) “除铁”步骤中加入双氧水发生反应的离子方程式是。
-
(4) “除铁”步骤中加入的纯碱作用是。
-
(5) 在“调pH”步骤中,加盐酸的作用是。
-
(6) 已知25℃时,Ksp[Fe(OH)3]=4.0×10-38 , 则该温度下反应Fe3++3H2O
 Fe(OH)3+3H+的平衡常数为。
Fe(OH)3+3H+的平衡常数为。

 ]与加入氨水体积的关系如图,下列说法错误的是( )
]与加入氨水体积的关系如图,下列说法错误的是( ) 
 )>c(Ag+)+C[Ag(NH3)
)>c(Ag+)+C[Ag(NH3)  ]+c(NH
]+c(NH  )
)
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚钠溶液中通入足量CO2 , 溶液变浑浊 | 酸性:H2CO3>C6H5OH>HCO3- |
| B | 向KBrO3溶液中通入少量Cl2 , 然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
| C | 将等浓度等体积的KI溶液和FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红 | 溶液中存在平衡:2Fe3++2I- |
| D | 向2支均盛有2mL相同浓度银氨溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Kap(AgI)>Kap(AgCl) |

| 选项 | 实验 | 现象 | 结论 |
| A | 向FeCl3溶液中通入足量的H2S | 生成两种沉淀 | Fe3+的氧化性强于S |
| B | 向浓度均为0.1 mol:L-1的CuSO4和MgSO4混合溶液中滴加少量NaOH溶液 | 先出现浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
| C | 向FeCl3溶液中滴入几滴30%的H2O2溶液 | 有气体产生,一段时间后,FeCl3溶液颜色加深 | Fe3+能催化H2O2 分解,且该分解反应为放热反应 |
| D | 铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体 | 加热时无明显现象,加入硝酸钾后溶液变蓝 | 硝酸钾起催化作用 |
实验内容 | 实验目的 | |
A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸分别测定浓度为18 mol·L-1和0.1 mol·L-1H2SO4溶液的pH | 比较不同浓度硫酸的酸性强弱 |
C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向盛有2 mL 0.01 mol·L-1 AgNO3溶液的试管中滴加2滴0.01 mol·L-1 NaCl溶液,有白色沉淀生成,再向其中滴加 2滴0.01 mol·L-1 NaI溶液,产生黄色沉淀 | 证明在相同温度下Ksp(AgCl)>Ksp(AgI) |
-
(1)
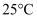 时,物质的量浓度均为
时,物质的量浓度均为 的几种盐溶液的
的几种盐溶液的 如下表所示。
如下表所示。序号
Ⅰ
Ⅱ
Ⅲ
溶液
 溶液
溶液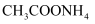 溶液
溶液 溶液
溶液
5
7
8.4
①溶液Ⅰ显酸性的原因是(用离子方程式表示)。
②溶液Ⅱ中,
 (填“>”“<”或“=”)
(填“>”“<”或“=”)  。
。③写出溶液Ⅲ中阴离子浓度由大到小的关系:。
-
(2) 几种离子开始沉淀时的
 如下表所示。
如下表所示。离子




7.6
5.2
10.4
①当向含相同浓度
 的溶液中滴加氢氧化钠溶液时,(填离子符号)最先沉淀。
的溶液中滴加氢氧化钠溶液时,(填离子符号)最先沉淀。②
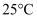 时,要使
时,要使 硫酸铜溶液中铜离子浓度降至原来的千分之一,则应向溶液里加入氢氧化钠溶液,使溶液
硫酸铜溶液中铜离子浓度降至原来的千分之一,则应向溶液里加入氢氧化钠溶液,使溶液 为。
为。
-
(3) 已知:
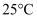 时,
时, 的电离常数
的电离常数 , 则该温度下
, 则该温度下 的水解平衡常数
的水解平衡常数 ,若向
,若向 溶液中加入少量的
溶液中加入少量的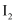 , 则溶液中
, 则溶液中 将(填“增大”“减小”或“不变”)。
将(填“增大”“减小”或“不变”)。
-
(4) 已知常温下
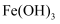 和
和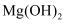 的
的 分别为
分别为 , 浓度均为
, 浓度均为 的
的 、
、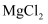 的混合溶液中.要使
的混合溶液中.要使 完全沉淀(离子浓度小于
完全沉淀(离子浓度小于 )而
)而 不沉淀,应该调节溶液
不沉淀,应该调节溶液 的范围是,调节
的范围是,调节 应选用的试剂是.(填化学式)。
应选用的试剂是.(填化学式)。

-
(1) “酸浸”时,加快化学反应速率的措施(写一条即可)。滤渣1的成分为(填化学式)。
-
(2) “氧化”时,Fe2+发生反应的离子方程式为,若用NaClO代替H2O2溶液,使0.1molFe2+转化为Fe3+ , 则需NaClO至少为 mol。
-
(3) MgO的作用是调节溶液pH使Fe3+沉淀,根据表中的数据,则调节溶液pH的范围是。
金属离子
Fe2+
Fe3+
Mg2+
Ni2+
开始沉淀的pH
6.3
1.5
8.9
6.9
沉淀完全的pH
8.3
2.8
10.9
8.9
-
(4) “沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是。
-
(5) “沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是。室温时,若“沉镍”后的滤液c(Ni2+)<1×10-5mol•L-1 , 则滤液中pH>。(Ksp[Ni(OH)2=1×10-15)
 及其化合物在国防技术、航空航天技术等领域扮演着重要的角色。一种利用湿法提锌的浸出渣(主要含一定量
及其化合物在国防技术、航空航天技术等领域扮演着重要的角色。一种利用湿法提锌的浸出渣(主要含一定量 和
和 的化合物)为原料制备高纯镓的流程如图所示:
的化合物)为原料制备高纯镓的流程如图所示:
已知:①溶液中的 会对电解
会对电解 溶液造成影响
溶液造成影响
② 与
与 可以发生反应
可以发生反应
③本流程温度下, ;
; ;
;
请回答下列问题:
-
(1) 滤渣1的主要成分为(填化学式)。
-
(2) “氧化”过程中发生反应的离子方程式为。
-
(3) “调
 沉淀除杂”过程需加入聚丙烯酰胺絮凝剂并加热的目的是。
沉淀除杂”过程需加入聚丙烯酰胺絮凝剂并加热的目的是。
-
(4) 溶液中
 的各种形态粒子的物质的量分数随溶液
的各种形态粒子的物质的量分数随溶液 变化的关系如图所示,用
变化的关系如图所示,用 “调
“调 沉淀除杂”的理论范围为。(溶液中剩余离子浓度小于
沉淀除杂”的理论范围为。(溶液中剩余离子浓度小于 时沉淀完全)
时沉淀完全)
-
(5) 试剂a的作用是。
-
(6) 流程中可以循环利用的物质是(填化学式)。
-
(7)
 、
、 、
、 可用于制取第三代半导体材料,熔点如表所示,分析其变化原因:。
可用于制取第三代半导体材料,熔点如表所示,分析其变化原因:。物质



熔点



 、
、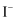 浓度均为
浓度均为 )进行实验:滴加一定量
)进行实验:滴加一定量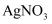 溶液,产生黄色沉淀;继续滴加,产生白色沉淀。已知:
溶液,产生黄色沉淀;继续滴加,产生白色沉淀。已知: 、
、 。下列分析错误的是( )
。下列分析错误的是( )
 , 白色沉淀是
, 白色沉淀是 B . 产生白色沉淀时,溶液中存在
B . 产生白色沉淀时,溶液中存在 C . 若起始时向卤水中滴加2滴(0.1
C . 若起始时向卤水中滴加2滴(0.1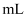 )
)
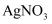 , 能产生沉淀
D . 白色沉淀开始析出时,
, 能产生沉淀
D . 白色沉淀开始析出时,
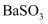 沉淀溶解平衡的说法中错误的是( )
沉淀溶解平衡的说法中错误的是( )
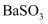 的溶度积常数表达式
的溶度积常数表达式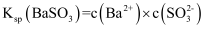 B .
B . 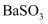 难溶于水,溶液中没有
难溶于水,溶液中没有 和SO
和SO C . 升高温度,
C . 升高温度,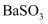 的溶解度增大
D . 向
的溶解度增大
D . 向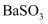 悬浊液中加入
悬浊液中加入 固体,
固体,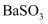 溶解的量减少
溶解的量减少
 2Fe2++I2
2Fe2++I2


