实验活动3 盐类水解的应用 知识点题库
根据题意解答
-
(1) 某温度下,在Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=3.2×10﹣11)、AgCl(Ksp=1.8×10﹣10)三种物质中,溶解度最小的是
-
(2) 在粗制CuSO4•5H2O晶体中常含有杂质Fe2+ . 在提纯时为了除去Fe2+ , 常加入氧化剂,使Fe2+氧化为Fe3+ , 下列物质最合适的是
A.KMnO4 B.H2O2 C.Cl2 水 D.HNO3
已知KMnO4氧化Fe2+时,生成Mn2+离子,试写出酸性KMnO4与Fe2+反应的离子反应方程式;然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3 , 可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A.NaOH B. NH3•H2O C.CuCO3 D.Cu(OH)2
-
(3) 甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10﹣38 , Cu(OH)2的溶度积Ksp=3.0×10﹣18 , 通常认为残留在溶液中的离子浓度小于1×10﹣5 mol•L﹣1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L﹣1 , 则Cu(OH)2开始沉淀时溶液的pH为,Fe3+完全沉淀时溶液的pH为(已知lg2=0.3,lg5=0.7),通过计算确定上述方案(填“可行”或“不可行”)
0.1mol•L﹣1K2CO3溶液中下列表达式不正确的是( )
A . c(K+)>c(CO32﹣)>c(OH﹣)>c (HCO3﹣)>c(H+)
B . c(K+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣)
C . c(HCO3﹣)+c(CO32﹣)+c(H2CO3)=0.1 mol•L﹣1
D . c(OH﹣)═c(H+)+2c(H2CO3)+c(HCO3﹣)
下列有关盐类水解的说法中,不正确的是( )
A . NaHCO3属于酸式盐,其水溶液显酸性
B . CuCl2水解的实质是Cu2+与水电离出来的OH﹣结合生成了弱电解质Cu(OH)2
C . 利用纯碱水解显碱性,可除去物品表面的油污
D . 明矾【KAl(SO4)2•12H2O】用于净水的原因是明矾电离产生的Al3+水解产生Al(OH)3胶体,Al(OH)3胶体吸附水中悬浮的杂质.
泡沫灭火器灭火原理:NaHCO3与Al2(SO4)3发生双水解反应离子方程式.
为了配制NH4+的浓度与Cl﹣的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
A . 适量的HCl
B . 适量的NaCl
C . 适量的氨水
D . NaOH
下列关于电解质溶液的正确判断是( )
A . 在pH=12的溶液中,K+、Cl﹣、HCO3﹣、Na+可以大量共存
B . 在pH=0的溶液中,Na+、NO3﹣、SO32﹣、K+可以大量共存
C . 由0.1mol•L﹣1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH﹣
D . 由0.1mol•L﹣1一元酸HA溶液的pH=3,可推知NaA溶液存在A﹣+H2O⇋HA+OH﹣
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
-
(1) 上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
-
(2) CH3COONH4的水溶液呈 (选填“酸性”“中性”或“碱性”),理由是,溶液中各离子浓度大小的关系是。
-
(3) 物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为。
-
(4) 工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.01mol·L-1以上,则溶液中CO32-物质的量浓度应 ≥mol·L-1。
一定温度下,下列溶液的离子浓度关系式正确的是( )
A . pH=5的H2S溶液中,c(H+)= c(HS-)=1×10-5 mol·L-1
B . pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C . pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D . pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
下列说法正确的是( )
A . 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B . SO3与Ba(NO3)2溶液反应可得到BaSO4 , SO2与Ba(NO3)2溶液可得到BaSO3
C . 明矾水解生成Al(OH)胶体,可用作净水剂
D . 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0
测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比试验,④产生白色沉淀多。下列说法错误的是( )
A . Na₂SO3溶液中存在水解平衡:SO32-+H2O  HSO-3+OH-
B . ④的pH与①不同,是由于SO32-浓度减小造成的
C . ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D . ①与④的Kw值相等
HSO-3+OH-
B . ④的pH与①不同,是由于SO32-浓度减小造成的
C . ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D . ①与④的Kw值相等
 HSO-3+OH-
B . ④的pH与①不同,是由于SO32-浓度减小造成的
C . ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D . ①与④的Kw值相等
HSO-3+OH-
B . ④的pH与①不同,是由于SO32-浓度减小造成的
C . ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D . ①与④的Kw值相等
下列有关说法正确的是( )
A . 一定条件下反应2SO2+O2  2SO3达到平衡时,v(O2)正=2v(SO3)逆
B . 用右图所示方法可保护钢闸门不被腐蚀
2SO3达到平衡时,v(O2)正=2v(SO3)逆
B . 用右图所示方法可保护钢闸门不被腐蚀 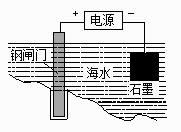 C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中
C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中  的值增大
D . 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
的值增大
D . 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
 2SO3达到平衡时,v(O2)正=2v(SO3)逆
B . 用右图所示方法可保护钢闸门不被腐蚀
2SO3达到平衡时,v(O2)正=2v(SO3)逆
B . 用右图所示方法可保护钢闸门不被腐蚀  C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中
C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中  的值增大
D . 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
的值增大
D . 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”——钛酸(BaTiO3)的工艺流程如下:
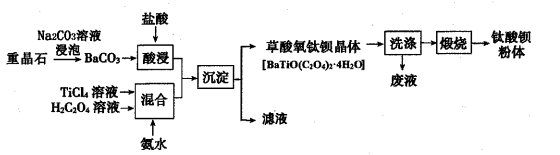
回答下列问题:
-
(1) 为提高BaCO3的酸浸速率,可采取的措施为(写出一条即可);常温下,TiCl4为液体且易水解,配制一定浓度的TiCl4溶液的方法是 。
-
(2) 用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3 , 此反应的平衡常数K= (填写计算结果);若不考虑CO32-的水解,要使2. 33g BaSO4恰好完全转化为BaCO3 , 则至少需要浓度为1.0mol·L-1Na2CO3溶液 mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
-
(3) 流程中“混合”溶液的钛元素在不同pH时主要以TiO(OH)+、TiOC2O4、TiO(C2O4)22-三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH于2.8左右,再进行“沉淀”,其反应的离子方程式为;图中曲线c对应钛的形式为(填粒子符号)。

-
(4) 流程中“滤液”的主要成分为;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和气态产物,试写出反应的化学方程式:。
在常温下,pH=2的氯化铁溶液,pH=2的硫酸溶液,pH=12的氨水溶液,pH=12的碳酸钠溶液,水的电离程度分别为a、b、c、d,则这四种溶液中,水的电离程度大小比较正确的是( )
A . a=d>b=c
B . a=d>c>b
C . b=c>a=d
D . b=c>a>d
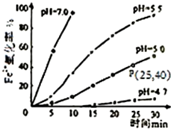
久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某硏究小组为硏究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
回答下列问题:
-
(1) 写出Fe2+水解的离子方程式;要抑制FeSO4水解,可以采取的措施是。
-
(2) 若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率。
-
(3) 在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2+4H+
 4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是。
4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是。 a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
-
(4) 结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响。
-
(5) 用K2Cr2O7标准溶液測定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待测溶液,用0.0200mol·L−1K2Cr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=mol·L−1。
化学与生活联系密切,下列说法正确的是( )
A . 《新修本草》中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑙璃,烧之赤色”这里的赤色是析出了Cu单质
B . 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C . 高纯度的单晶硅可用于制造太阳能电池板和光导纤维
D . 酸雨既能腐蚀建筑物也能破坏农作物
现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
-
(1) ①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)。
-
(2) ④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号) 。
-
(3) 将②、③混合后,若溶液呈中性,则消耗两溶液的体积为 ② ③(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为
-
(4) 常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①其中有两种粒子的物质的量之和一定等于0.010 mol,它们是和。
②溶液中c(CH3COO-)+n(OH-)-n(H+)= mol。
下列物质,因水解而使溶液呈酸性的是( )
A . CH3COOH
B . NaHCO3
C . NH4Cl
D . HCl
 时,下列溶液中微粒的物质的量浓度关系正确的是( )
时,下列溶液中微粒的物质的量浓度关系正确的是( )
A .  的
的  溶液中:
溶液中:  B .
B .  溶液中:
溶液中:  C .
C . 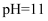 的氨水和
的氨水和 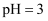 的盐酸等体积的混合液中:
的盐酸等体积的混合液中:  D . 向
D . 向  溶液中滴加氨水溶液至中性:
溶液中滴加氨水溶液至中性: 
 的
的  溶液中:
溶液中:  B .
B .  溶液中:
溶液中:  C .
C . 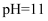 的氨水和
的氨水和 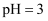 的盐酸等体积的混合液中:
的盐酸等体积的混合液中:  D . 向
D . 向  溶液中滴加氨水溶液至中性:
溶液中滴加氨水溶液至中性: 
25℃时,向20 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,溶液的pH与所加NaOH溶液体积的关系如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法错误的是( )

A . 在a→d的过程中,a点的溶液中水的电离程度最大
B . 在b点的溶液中,c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
C . 在c点的溶液中,c(SO42-)+c(H+)=c(NH3·H2O)+c(OH-)
D . 在c→d的过程中,溶液中c(NH4+)+c(NH3·H2O)+c(Na+)=0.1 mol/L始终成立
设  为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A .  时,
时,  的
的 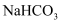 溶液中含有
溶液中含有  的数目为
的数目为  B .
B .  和
和 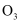 的混合物共16g,其中所含氧原子数为
的混合物共16g,其中所含氧原子数为  C . 已知
C . 已知  ,将
,将  个
个  与
与 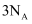 个
个  混合充分反应,放出
混合充分反应,放出  的热量
D . 将
的热量
D . 将 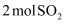 和
和 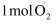 在密闭容器中加热(
在密闭容器中加热(  催化)充分反应,容器内分子总数为
催化)充分反应,容器内分子总数为 
 时,
时,  的
的 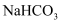 溶液中含有
溶液中含有  的数目为
的数目为  B .
B .  和
和 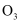 的混合物共16g,其中所含氧原子数为
的混合物共16g,其中所含氧原子数为  C . 已知
C . 已知  ,将
,将  个
个  与
与 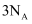 个
个  混合充分反应,放出
混合充分反应,放出  的热量
D . 将
的热量
D . 将 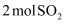 和
和 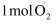 在密闭容器中加热(
在密闭容器中加热(  催化)充分反应,容器内分子总数为
催化)充分反应,容器内分子总数为 
最近更新



