дё“йўҳ3 д»Һжө·ж°ҙдёӯиҺ·еҫ—зҡ„еҢ–еӯҰзү©иҙЁ зҹҘиҜҶзӮ№йўҳеә“
е°Ҷ1 mol CH4е’ҢйҖӮйҮҸзҡ„O2еңЁеҜҶй—ӯе®№еҷЁдёӯзӮ№зҮғпјҢе……еҲҶеҸҚеә”еҗҺпјҢCH4е’ҢO2еқҮж— еү©дҪҷпјҢдё”дә§зү©еқҮдёәж°”дҪ“(101kPaпјҢ120в„ғ)пјҢжҖ»иҙЁйҮҸдёә72gпјҢдёӢеҲ—жңүе…іеҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . иӢҘе°Ҷдә§зү©йҖҡиҝҮзўұзҹізҒ°пјҢеҲҷдёҚиғҪиў«е®Ңе…Ёеҗёж”¶
B . дә§зү©зҡ„е№іеқҮж‘©е°”иҙЁйҮҸдёә24g/mol
C . иӢҘе°Ҷдә§зү©йҖҡиҝҮжө“зЎ«й…ёпјҢе……еҲҶеҗёж”¶еҗҺпјҢжө“зЎ«й…ёеўһйҮҚ18g
D . еҸҚеә”дёӯж¶ҲиҖ—O256g
зЎјй•ҒжіҘжҳҜдёҖз§Қе·Ҙдёҡеәҹж–ҷпјҢдё»иҰҒжҲҗеҲҶжҳҜMgO(еҚ 40%)пјҢиҝҳжңүCaOгҖҒMnOгҖҒFe2O3гҖҒFeOгҖҒAl2O3гҖҒSiO2зӯүжқӮиҙЁпјҢд»ҘжӯӨдёәеҺҹж–ҷеҲ¶еҸ–зҡ„зЎ«й…ёй•ҒеҸҜз”ЁдәҺеҚ°жҹ“гҖҒйҖ зәёгҖҒеҢ»иҚҜзӯүе·ҘдёҡгҖӮд»ҺзЎјй•ҒжіҘдёӯжҸҗеҸ–MgSO4В·7H2Oзҡ„жөҒзЁӢеҰӮдёӢпјҡ

ж №жҚ®йўҳж„Ҹеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү е®һйӘҢдёӯйңҖз”Ё1 molВ·LпјҚ1зҡ„зЎ«й…ё800 mLпјҢиӢҘз”Ё18.4 molВ·LпјҚ1зҡ„жө“зЎ«й…ёжқҘй…ҚеҲ¶пјҢйҮҸеҸ–жө“зЎ«й…ёж—¶пјҢйңҖдҪҝз”Ёзҡ„йҮҸзӯ’зҡ„и§„ж јдёә________гҖӮA . 10 mL B . 20 mL C . 50 mL D . 100 mL
-
пјҲ2пјү еҠ е…Ҙзҡ„NaClOеҸҜе°ҶMn2пјӢж°§еҢ–дёәMnO2 пјҢ еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡпјҢиҝҳжңүдёҖз§ҚзҰ»еӯҗд№ҹдјҡиў«NaClOж°§еҢ–пјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
-
пјҲ3пјү ж»ӨжёЈзҡ„дё»иҰҒжҲҗеҲҶдёӯйҷӨеҗ«жңүFe(OH)3гҖҒAl(OH)3еӨ–иҝҳжңүгҖӮ
-
пјҲ4пјү еңЁвҖңйҷӨй’ҷвҖқеүҚпјҢйңҖжЈҖйӘҢж»Өж¶ІдёӯFe3пјӢжҳҜеҗҰиў«йҷӨе°ҪпјҢз®Җиҝ°жЈҖйӘҢж–№жі•пјҡгҖӮ
-
пјҲ5пјү е·ІзҹҘMgSO4гҖҒCaSO4зҡ„жә¶и§ЈеәҰеҰӮдёӢиЎЁпјҡ
жё©еәҰ/в„ғ
40
50
60
70
S(MgSO4)/g
30.9
33.4
35.6
36.9
S(CaSO4)/g
0.210
0.207
0.201
0.193
вҖңйҷӨй’ҷвҖқжҳҜе°ҶMgSO4е’ҢCaSO4зҡ„ж··еҗҲжә¶ж¶Ідёӯзҡ„CaSO4йҷӨеҺ»пјҢж №жҚ®дёҠиЎЁж•°жҚ®пјҢеҸҜзЎ®е®ҡж“ҚдҪңжӯҘйӘӨдёәи’ёеҸ‘з»“жҷ¶гҖҒпјҲеЎ«ж“ҚдҪңеҗҚз§°пјүгҖӮ
-
пјҲ6пјү е®һйӘҢдёӯжҸҗдҫӣзҡ„зЎјй•ҒжіҘе…ұ10 gпјҢеҫ—еҲ°MgSO4В·7H2Oе…ұ17.22 gпјҢеҲҷMgSO4В·7H2Oзҡ„дә§зҺҮдёәгҖӮ
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®жҳҜпјҲ пјү
A . йҶӢй…ёе’Ңзўій…ёй’ҷеҸҚеә”пјҡ2H++CaCO3=Ca2++CO2вҶ‘+H2O
B . й“ҒдёҺдёүж°ҜеҢ–й“Ғжә¶ж¶ІеҸҚеә”пјҡFe+Fe3+=2Fe2+
C . ж°ўж°§еҢ–й’ жә¶ж¶ІдёҺе°‘йҮҸдәҢж°§еҢ–зЎ«ж°”дҪ“пјҡSO2+2OH-=SO32-+H2O
D . ж°ҜеҢ–й“қжә¶ж¶ІдёҺи¶ійҮҸж°Ёж°ҙпјҡAl3++4NH3В·H2O=AlO2-+4NH4++2H2O
еёёжё©дёӢпјҢеңЁвҖңH2SвҖ”HS-вҖ”S2-вҖқзҡ„ж°ҙжә¶ж¶ІдҪ“зі»дёӯпјҢH2SгҖҒHS-гҖҒS2-дёүз§Қеҫ®зІ’зҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°йҡҸжә¶ж¶ІpHеҸҳеҢ–пјҲд»…з”ЁH2Sе’ҢNaOHи°ғиҠӮpH)зҡ„е…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү

A . Kal(H2S)зҡ„ж•°йҮҸзә§дёә10-6
B . NaHSжә¶ж¶ІдёӯпјҢc(Na+)>c(HS-)>c(S2-)>c(H2S)
C . еҪ“дҪ“зі»е‘ҲдёӯжҖ§ж—¶пјҢ  >
>  D . еҠ е…ҘNa2SжІүйҷҚеәҹж°ҙдёӯзҡ„Cu2+ пјҢ еәҹж°ҙзҡ„pHеҜ№жІүйҷҚж•ҲжһңжІЎжңүеҪұе“Қ
D . еҠ е…ҘNa2SжІүйҷҚеәҹж°ҙдёӯзҡ„Cu2+ пјҢ еәҹж°ҙзҡ„pHеҜ№жІүйҷҚж•ҲжһңжІЎжңүеҪұе“Қ
 >
>  D . еҠ е…ҘNa2SжІүйҷҚеәҹж°ҙдёӯзҡ„Cu2+ пјҢ еәҹж°ҙзҡ„pHеҜ№жІүйҷҚж•ҲжһңжІЎжңүеҪұе“Қ
D . еҠ е…ҘNa2SжІүйҷҚеәҹж°ҙдёӯзҡ„Cu2+ пјҢ еәҹж°ҙзҡ„pHеҜ№жІүйҷҚж•ҲжһңжІЎжңүеҪұе“Қ
иҚүй…ёдәҡй“Ғжҷ¶дҪ“(FeC2O4вҖўxH2O)еңЁз”өжұ е·ҘдёҡгҖҒеҲ¶иҚҜгҖҒз…§зүҮжҳҫеҪұзӯүж–№йқўжңүйҮҚиҰҒдҪңз”ЁгҖӮеңЁе®һйӘҢе®Өдёӯз”ЁеҲ¶еӨҮиҚүй…ёдәҡй“Ғе№¶з ”з©¶е…¶жҖ§иҙЁпјҢе…·дҪ“жөҒзЁӢеҰӮеӣҫпјҡ
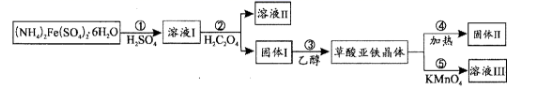
е·ІзҹҘпјҡеёёжё©дёӢпјҢpH>4ж—¶пјҢFe2+е®№жҳ“иў«ж°§еҢ–пјӣH2C2O4зҡ„Ka1=5.9Г—10-2 пјҢ Ka2=6.5Г—10-5пјӣKsp(FeC2O4вҖўxH2O)=3.2Г—10-7
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү жӯҘйӘӨв‘ з”Ёж°ҙжә¶и§Јзҡ„иҝҮзЁӢдёӯпјҢеҠ е…Ҙе°‘йҮҸзЁҖH2SO4зҡ„дҪңз”ЁжҳҜгҖӮ
-
пјҲ2пјү жӯҘйӘӨв‘ЎдёӯеҠ е…Ҙзҡ„H2C2O4еұһдәҺй…ёпјҢз”ҹжҲҗеӣәдҪ“Iзҡ„зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸдёәгҖӮ
-
пјҲ3пјү жӯҘйӘӨв‘ўдёӯе…Ҳз”Ёж°ҙжҙ—ж¶ӨпјҢеҶҚз”Ёд№ҷйҶҮжҙ—ж¶ӨпјҢе…¶зӣ®зҡ„жҳҜгҖӮ
-
пјҲ4пјү жӯҘйӘӨв‘ЈжҳҜжЈҖйӘҢиҚүй…ёдәҡй“Ғжҷ¶дҪ“еҠ зғӯеҲҶи§ЈеҗҺзҡ„дә§зү©H2OгҖҒCOгҖҒCO2 пјҢ йҰ–е…ҲжЈҖйӘҢзҡ„ж°”дҪ“дёәпјҢ然еҗҺе°Ҷеү©дҪҷж°”дҪ“дҫқж¬ЎйҖҡиҝҮпјҲеЎ«еәҸеҸ·пјҢиЈ…зҪ®еҸҜйҮҚеӨҚдҪҝз”ЁпјүвҶ’е°ҫж°”еӨ„зҗҶгҖӮе®һйӘҢеүҚйңҖиҰҒе°ҶиЈ…зҪ®дёӯзҡ„з©әж°”жҺ’е°ҪпјҢзҗҶз”ұжҳҜгҖӮ
-
пјҲ5пјү жӯҘйӘӨв‘ӨйҮҮз”Ёж»ҙе®ҡеҲҶжһҗжі•жөӢе®ҡFeC2O4вҖўxH2Oдёӯxзҡ„еҖјгҖӮеҸ–0.18gж ·е“Ғжә¶дәҺзЁҖзЎ«й…ёй…ҚжҲҗ100.00mLжә¶ж¶ІпјҢеҸ–20.00mLдәҺй”ҘеҪўз“¶дёӯпјҢз”Ё0.0100molвҖўL-1KMnO4жә¶ж¶Іж»ҙе®ҡиҮіз»ҲзӮ№пјҢж¶ҲиҖ—KMnO4жә¶ж¶І12.00mLгҖӮж»ҙе®ҡз»ҲзӮ№зҡ„зҺ°иұЎдёәпјҢxеҖјдёәгҖӮ
еҗ‘H2SO4е’ҢNH4Al(SO4)2зҡ„ж··еҗҲжә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶ІпјҢдёҚеҸҜиғҪеҸ‘з”ҹпјҲ пјү
A . H+пјӢOH-вҶ’H2O
B . Al3+пјӢ4NH3В·H2OвҶ’AlO2-пјӢ4NH4+пјӢ2H2O
C . NH4+пјӢOH-вҶ’NH3В·H2O
D . Al(OH)3пјӢOH-вҶ’AlO2-пјӢ2H2O
XгҖҒYгҖҒZгҖҒWжңүеҰӮеӣҫжүҖзӨәзҡ„иҪ¬еҢ–е…ізі»пјҲеҸҚеә”жқЎд»¶е’ҢйғЁеҲҶе…¶е®ғеҸҚеә”зү©зңҒз•Ҙпјү еҲҷXгҖҒYгҖҒZеҸҜиғҪжҳҜпјҲ пјү

в‘ NaгҖҒNa2OгҖҒNa2O2 в‘ЎAlCl3гҖҒAlпјҲOHпјү3гҖҒ NaAlO2 в‘ў FeгҖҒ FeCl2гҖҒFeCl3 в‘ЈNaOHгҖҒNa2CO3 гҖҒNaHCO3 в‘ӨCгҖҒCOгҖҒCO2
A . в‘ в‘Ўв‘Јв‘Ө
B . в‘ в‘ўв‘Ө
C . в‘Ўв‘Ј
D . в‘ в‘Ўв‘ўв‘Јв‘Ө
й’ зҡ„еҢ–еҗҲзү©еңЁз”ҹдә§е’Ңз”ҹжҙ»дёӯиө·еҲ°йҮҚиҰҒзҡ„дҪңз”ЁгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү зўій…ёж°ўй’ дҝ—з§°пјҢж°ҙжә¶ж¶Іе‘ҲжҖ§гҖӮ
-
пјҲ2пјү зўій…ёж°ўй’ зІүжң«еҸҜз”ЁдәҺжІ»з–—иғғй…ёпјҲ0.2%пҪһ0.4%зҡ„зӣҗй…ёпјүиҝҮеӨҡпјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜпјӣ
-
пјҲ3пјү йҷӨеҺ»Na2CO3зІүжң«дёӯNaHCO3зҡ„ж–№жі•жҳҜпјҢжүҖж¶үеҸҠзҡ„еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
дёӢеҲ—жҢҮе®ҡеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . Cl2йҖҡе…Ҙж°ҙдёӯеҲ¶ж°Ҝж°ҙпјҡCl2+H2O  2H++Cl-+ClO-
B . й“…й…ёи“„з”өжұ е……з”өж—¶зҡ„жӯЈжһҒеҸҚеә”пјҡPbSO4пјӢ2H2OпјҚ2e- = PbO2пјӢ4HпјӢпјӢSO
2H++Cl-+ClO-
B . й“…й…ёи“„з”өжұ е……з”өж—¶зҡ„жӯЈжһҒеҸҚеә”пјҡPbSO4пјӢ2H2OпјҚ2e- = PbO2пјӢ4HпјӢпјӢSO  C .
C .  NaAlO2жә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸCO2пјҡAlO
NaAlO2жә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸCO2пјҡAlO  +CO2+2H2O=Al(OH)3вҶ“+HCO
+CO2+2H2O=Al(OH)3вҶ“+HCO  D .
D .  AgNO3жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸжө“ж°Ёж°ҙпјҡAg++NH3В·H2O=AgOHвҶ“+NH
AgNO3жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸжө“ж°Ёж°ҙпјҡAg++NH3В·H2O=AgOHвҶ“+NH 
 2H++Cl-+ClO-
B . й“…й…ёи“„з”өжұ е……з”өж—¶зҡ„жӯЈжһҒеҸҚеә”пјҡPbSO4пјӢ2H2OпјҚ2e- = PbO2пјӢ4HпјӢпјӢSO
2H++Cl-+ClO-
B . й“…й…ёи“„з”өжұ е……з”өж—¶зҡ„жӯЈжһҒеҸҚеә”пјҡPbSO4пјӢ2H2OпјҚ2e- = PbO2пјӢ4HпјӢпјӢSO  C .
C .  NaAlO2жә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸCO2пјҡAlO
NaAlO2жә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸCO2пјҡAlO  +CO2+2H2O=Al(OH)3вҶ“+HCO
+CO2+2H2O=Al(OH)3вҶ“+HCO  D .
D .  AgNO3жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸжө“ж°Ёж°ҙпјҡAg++NH3В·H2O=AgOHвҶ“+NH
AgNO3жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸжө“ж°Ёж°ҙпјҡAg++NH3В·H2O=AgOHвҶ“+NH 
еҢ–еӯҰе®һйӘҢе®Өдә§з”ҹзҡ„еәҹж¶Ідёӯеҗ«жңүеӨ§йҮҸдјҡжұЎжҹ“зҺҜеўғзҡ„зү©иҙЁпјҢдёәдәҶдҝқжҠӨзҺҜеўғпјҢиҝҷдәӣеәҹж¶Іеҝ…йЎ»з»ҸеӨ„зҗҶеҗҺжүҚиғҪжҺ’ж”ҫгҖӮжҹҗеҢ–еӯҰе®һйӘҢе®Өдә§з”ҹзҡ„еәҹж¶Ідёӯеҗ«жңүдёӨз§ҚйҮ‘еұһзҰ»еӯҗпјҡFe3пјӢгҖҒCu2пјӢ пјҢ еҢ–еӯҰе°Ҹз»„и®ҫи®ЎдәҶеҰӮдёӢеӣҫжүҖзӨәзҡ„ж–№жЎҲеҜ№еәҹж¶ІиҝӣиЎҢеӨ„зҗҶпјҢд»Ҙеӣһ收йҮ‘еұһпјҢдҝқжҠӨзҺҜеўғгҖӮ

-
пјҲ1пјү ж“ҚдҪңв‘ зҡ„еҗҚз§°жҳҜпјҢз”ЁеҲ°зҡ„дё»иҰҒзҺ»з’ғд»ӘеҷЁжңүзғ§жқҜгҖҒгҖӮ
-
пјҲ2пјү жІүж·ҖAдёӯеҗ«жңүзҡ„йҮ‘еұһеҚ•иҙЁжңүгҖӮ
-
пјҲ3пјү ж“ҚдҪңв‘Ўдёӯи§ӮеҜҹеҲ°зҡ„е®һйӘҢзҺ°иұЎжҳҜгҖӮ
-
пјҲ4пјү ж“ҚдҪңв‘ЎгҖҒв‘ўдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸеҲҶеҲ«дёәгҖҒгҖӮ
дёӢеҲ—з”өзҰ»ж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . NaHSO4 = Na+ + HSO  B . Fe2(SO4)3 = Fe3+ + SO
B . Fe2(SO4)3 = Fe3+ + SO  C . NH3В·H2OвҮҢNH
C . NH3В·H2OвҮҢNH  +OH-
D . CH3COOH = CH3COO- + H+
+OH-
D . CH3COOH = CH3COO- + H+
 B . Fe2(SO4)3 = Fe3+ + SO
B . Fe2(SO4)3 = Fe3+ + SO  C . NH3В·H2OвҮҢNH
C . NH3В·H2OвҮҢNH  +OH-
D . CH3COOH = CH3COO- + H+
+OH-
D . CH3COOH = CH3COO- + H+
и®ҫ  дёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ( )
дёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ( )
 дёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ( )
дёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ( )
A . еёёжё©дёӢпјҢ8g  дёӯеҗ«жңүзҡ„еҺҹеӯҗжҖ»ж•°дёә
дёӯеҗ«жңүзҡ„еҺҹеӯҗжҖ»ж•°дёә  B . ж ҮеҮҶзҠ¶еҶөдёӢпјҢ2.24Lз”ұ
B . ж ҮеҮҶзҠ¶еҶөдёӢпјҢ2.24Lз”ұ  е’Ң
е’Ң  з»„жҲҗзҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„еҲҶеӯҗж•°дёә
з»„жҲҗзҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„еҲҶеӯҗж•°дёә  C . 1 mol
C . 1 mol  иў«иҝҳеҺҹдёә
иў«иҝҳеҺҹдёә 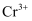 ж—¶иҪ¬з§»зҡ„з”өеӯҗж•°дёә
ж—¶иҪ¬з§»зҡ„з”өеӯҗж•°дёә  D .
D .  зҡ„
зҡ„  жә¶ж¶Ідёӯеҗ«жңүзҡ„йҳізҰ»еӯҗж•°дёә
жә¶ж¶Ідёӯеҗ«жңүзҡ„йҳізҰ»еӯҗж•°дёә 
 дёӯеҗ«жңүзҡ„еҺҹеӯҗжҖ»ж•°дёә
дёӯеҗ«жңүзҡ„еҺҹеӯҗжҖ»ж•°дёә  B . ж ҮеҮҶзҠ¶еҶөдёӢпјҢ2.24Lз”ұ
B . ж ҮеҮҶзҠ¶еҶөдёӢпјҢ2.24Lз”ұ  е’Ң
е’Ң  з»„жҲҗзҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„еҲҶеӯҗж•°дёә
з»„жҲҗзҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„еҲҶеӯҗж•°дёә  C . 1 mol
C . 1 mol  иў«иҝҳеҺҹдёә
иў«иҝҳеҺҹдёә 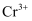 ж—¶иҪ¬з§»зҡ„з”өеӯҗж•°дёә
ж—¶иҪ¬з§»зҡ„з”өеӯҗж•°дёә  D .
D .  зҡ„
зҡ„  жә¶ж¶Ідёӯеҗ«жңүзҡ„йҳізҰ»еӯҗж•°дёә
жә¶ж¶Ідёӯеҗ«жңүзҡ„йҳізҰ»еӯҗж•°дёә 
еёёжё©дёӢз”ЁpHдёә3зҡ„жҹҗй…ёжә¶ж¶ІеҲҶеҲ«дёҺpHйғҪдёә11зҡ„ж°Ёж°ҙгҖҒж°ўж°§еҢ–й’ жә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲеҫ—еҲ°aгҖҒbдёӨз§Қжә¶ж¶ІпјҢе…ідәҺиҝҷдёӨз§Қжә¶ж¶Ій…ёзўұжҖ§зҡ„жҸҸиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . bдёҚеҸҜиғҪжҳҫзўұжҖ§
B . aеҸҜиғҪжҳҫй…ёжҖ§жҲ–зўұжҖ§
C . aдёҚеҸҜиғҪжҳҫй…ёжҖ§
D . bеҸҜиғҪжҳҫзўұжҖ§жҲ–й…ёжҖ§
иғҪеңЁж°ҙжә¶ж¶ІдёӯеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜпјҲ пјү
A . HпјӢгҖҒBa2+гҖҒ  гҖҒI-
B . Ba2+гҖҒ
гҖҒI-
B . Ba2+гҖҒ  гҖҒOH-гҖҒ
гҖҒOH-гҖҒ  C . Fe2+гҖҒHпјӢгҖҒCl-гҖҒ
C . Fe2+гҖҒHпјӢгҖҒCl-гҖҒ  D . KпјӢгҖҒ
D . KпјӢгҖҒ  гҖҒCl-гҖҒOH-
гҖҒCl-гҖҒOH-
 гҖҒI-
B . Ba2+гҖҒ
гҖҒI-
B . Ba2+гҖҒ  гҖҒOH-гҖҒ
гҖҒOH-гҖҒ  C . Fe2+гҖҒHпјӢгҖҒCl-гҖҒ
C . Fe2+гҖҒHпјӢгҖҒCl-гҖҒ  D . KпјӢгҖҒ
D . KпјӢгҖҒ  гҖҒCl-гҖҒOH-
гҖҒCl-гҖҒOH-
дёӢеҲ—е…ідәҺзү©иҙЁжҖ§иҙЁиҜҙжі•еҗҲзҗҶзҡ„жҳҜпјҲ пјү
A .  гҖҒ
гҖҒ  гҖҒ
гҖҒ  еқҮеҸҜд»Ҙз”ұзӣёеә”еҚ•иҙЁзӣҙжҺҘеҢ–еҗҲз”ҹжҲҗ
B . жө“зӣҗй…ёгҖҒжө“зЎқй…ёгҖҒжө“зЎ«й…ёеқҮеҸҜз”Ёй“қзҪҗиҪҰиҝҗиҫ“
C . зӯүиҙЁйҮҸзҡ„й“ңеҲҶеҲ«дёҺи¶ійҮҸзҡ„жө“зЎқй…ёе’ҢзЁҖзЎқй…ёе……еҲҶеҸҚеә”пјҢиҪ¬з§»зҡ„з”өеӯҗж•°зӣёзӯү
D . е°Ҷж°Ҝж°”йҖҡе…Ҙзҙ«иүІзҹіи•Ҡжә¶ж¶ІдёӯпјҢжә¶ж¶Іе…ҲеҸҳзәўеҗҺиӨӘиүІпјҢиҜҙжҳҺж°Ҝж°”е…·жңүжјӮзҷҪжҖ§е’Ңй…ёжҖ§
еқҮеҸҜд»Ҙз”ұзӣёеә”еҚ•иҙЁзӣҙжҺҘеҢ–еҗҲз”ҹжҲҗ
B . жө“зӣҗй…ёгҖҒжө“зЎқй…ёгҖҒжө“зЎ«й…ёеқҮеҸҜз”Ёй“қзҪҗиҪҰиҝҗиҫ“
C . зӯүиҙЁйҮҸзҡ„й“ңеҲҶеҲ«дёҺи¶ійҮҸзҡ„жө“зЎқй…ёе’ҢзЁҖзЎқй…ёе……еҲҶеҸҚеә”пјҢиҪ¬з§»зҡ„з”өеӯҗж•°зӣёзӯү
D . е°Ҷж°Ҝж°”йҖҡе…Ҙзҙ«иүІзҹіи•Ҡжә¶ж¶ІдёӯпјҢжә¶ж¶Іе…ҲеҸҳзәўеҗҺиӨӘиүІпјҢиҜҙжҳҺж°Ҝж°”е…·жңүжјӮзҷҪжҖ§е’Ңй…ёжҖ§
 гҖҒ
гҖҒ  гҖҒ
гҖҒ  еқҮеҸҜд»Ҙз”ұзӣёеә”еҚ•иҙЁзӣҙжҺҘеҢ–еҗҲз”ҹжҲҗ
B . жө“зӣҗй…ёгҖҒжө“зЎқй…ёгҖҒжө“зЎ«й…ёеқҮеҸҜз”Ёй“қзҪҗиҪҰиҝҗиҫ“
C . зӯүиҙЁйҮҸзҡ„й“ңеҲҶеҲ«дёҺи¶ійҮҸзҡ„жө“зЎқй…ёе’ҢзЁҖзЎқй…ёе……еҲҶеҸҚеә”пјҢиҪ¬з§»зҡ„з”өеӯҗж•°зӣёзӯү
D . е°Ҷж°Ҝж°”йҖҡе…Ҙзҙ«иүІзҹіи•Ҡжә¶ж¶ІдёӯпјҢжә¶ж¶Іе…ҲеҸҳзәўеҗҺиӨӘиүІпјҢиҜҙжҳҺж°Ҝж°”е…·жңүжјӮзҷҪжҖ§е’Ңй…ёжҖ§
еқҮеҸҜд»Ҙз”ұзӣёеә”еҚ•иҙЁзӣҙжҺҘеҢ–еҗҲз”ҹжҲҗ
B . жө“зӣҗй…ёгҖҒжө“зЎқй…ёгҖҒжө“зЎ«й…ёеқҮеҸҜз”Ёй“қзҪҗиҪҰиҝҗиҫ“
C . зӯүиҙЁйҮҸзҡ„й“ңеҲҶеҲ«дёҺи¶ійҮҸзҡ„жө“зЎқй…ёе’ҢзЁҖзЎқй…ёе……еҲҶеҸҚеә”пјҢиҪ¬з§»зҡ„з”өеӯҗж•°зӣёзӯү
D . е°Ҷж°Ҝж°”йҖҡе…Ҙзҙ«иүІзҹіи•Ҡжә¶ж¶ІдёӯпјҢжә¶ж¶Іе…ҲеҸҳзәўеҗҺиӨӘиүІпјҢиҜҙжҳҺж°Ҝж°”е…·жңүжјӮзҷҪжҖ§е’Ңй…ёжҖ§
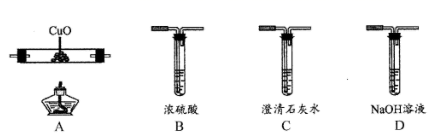
жҹҗе°Ҹз»„з”ЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®иҝӣиЎҢе®һйӘҢ(еӨ№жҢҒд»ӘеҷЁе’ҢAдёӯеҠ зғӯиЈ…зҪ®е·Із•Ҙ)пјҢд»ҘйӘҢиҜҒ  гҖҒ
гҖҒ  гҖҒ
гҖҒ  ж°§еҢ–жҖ§зҡ„ејәејұгҖӮж №жҚ®йўҳзӣ®иҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
ж°§еҢ–жҖ§зҡ„ејәејұгҖӮж №жҚ®йўҳзӣ®иҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
 гҖҒ
гҖҒ  гҖҒ
гҖҒ  ж°§еҢ–жҖ§зҡ„ејәејұгҖӮж №жҚ®йўҳзӣ®иҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
ж°§еҢ–жҖ§зҡ„ејәејұгҖӮж №жҚ®йўҳзӣ®иҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ 
-
пјҲ1пјү жЈҖжҹҘиЈ…зҪ®ж°”еҜҶжҖ§еҗҺпјҢе…ій—ӯ
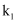 гҖҒ
гҖҒ  гҖҒ
гҖҒ  пјҢжү“ејҖ
пјҢжү“ејҖ  пјҢж—ӢејҖж—ӢеЎһaпјҢеҠ зғӯAпјҢеҲҷBдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
пјҢж—ӢејҖж—ӢеЎһaпјҢеҠ зғӯAпјҢеҲҷBдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
-
пјҲ2пјү Bдёӯжә¶ж¶ІеҸҳй»„ж—¶пјҢеҒңжӯўеҠ зғӯAпјҢе…ій—ӯ
 гҖӮжү“ејҖж—ӢеЎһbпјҢдҪҝзәҰ2mLзҡ„жә¶ж¶ІжөҒе…ҘиҜ•з®ЎDдёӯпјҢе…ій—ӯж—ӢеЎһbпјҢжЈҖйӘҢе®һйӘҢдёӯBз”ҹжҲҗзҰ»еӯҗзҡ„ж–№жі•жҳҜгҖӮ
гҖӮжү“ејҖж—ӢеЎһbпјҢдҪҝзәҰ2mLзҡ„жә¶ж¶ІжөҒе…ҘиҜ•з®ЎDдёӯпјҢе…ій—ӯж—ӢеЎһbпјҢжЈҖйӘҢе®һйӘҢдёӯBз”ҹжҲҗзҰ»еӯҗзҡ„ж–№жі•жҳҜгҖӮ
-
пјҲ3пјү иӢҘиҰҒ继з»ӯиҜҒжҳҺ
 е’Ң
е’Ң  ж°§еҢ–жҖ§зҡ„ејәејұпјҢйңҖиҰҒиҝӣиЎҢзҡ„ж“ҚдҪңжҳҜгҖӮ
ж°§еҢ–жҖ§зҡ„ејәејұпјҢйңҖиҰҒиҝӣиЎҢзҡ„ж“ҚдҪңжҳҜгҖӮ
-
пјҲ4пјү з”ІгҖҒд№ҷгҖҒдёҷдёүдҪҚеҗҢеӯҰеҲҶеҲ«е®ҢжҲҗдәҶдёҠиҝ°е®һйӘҢпјҢз»“и®әеҰӮиЎЁжүҖзӨәпјҢ他们зҡ„жЈҖжөӢз»“жһңдёҖе®ҡиғҪеӨҹиҜҒжҳҺж°§еҢ–жҖ§ејәејұйЎәеәҸпјҡ
 зҡ„жҳҜ(еЎ«вҖңз”ІвҖқгҖҒвҖңд№ҷвҖқжҲ–вҖңдёҷвҖқ)гҖӮ
зҡ„жҳҜ(еЎ«вҖңз”ІвҖқгҖҒвҖңд№ҷвҖқжҲ–вҖңдёҷвҖқ)гҖӮ иҝҮзЁӢ(2)дёӯжә¶ж¶Іеҗ«жңүзҡ„зҰ»еӯҗ
иҝҮзЁӢ(3)дёӯжә¶ж¶Іеҗ«жңүзҡ„зҰ»еӯҗ
з”І
ж—ўжңү
 еҸҲжңү
еҸҲжңү 
жңү

д№ҷ
жңү
 ж—
ж— 
жңү

дёҷ
жңү
 ж—
ж— 
жңү

-
пјҲ5пјү йӘҢиҜҒз»“жқҹеҗҺпјҢе°ҶDжҚўжҲҗзӣӣжңүNaOHжә¶ж¶Ізҡ„зғ§жқҜпјҢж—ӢејҖ
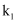 гҖҒ
гҖҒ  гҖҒ
гҖҒ  е’Ң
е’Ң  пјҢе…ій—ӯж—ӢеЎһaгҖҒcпјҢжү“ејҖж—ӢеЎһbпјҢд»ҺдёӨз«Ҝйј“е…Ҙ
пјҢе…ій—ӯж—ӢеЎһaгҖҒcпјҢжү“ејҖж—ӢеЎһbпјҢд»ҺдёӨз«Ҝйј“е…Ҙ  пјҢиҝҷж ·еҒҡзҡ„зӣ®зҡ„жҳҜ
пјҢиҝҷж ·еҒҡзҡ„зӣ®зҡ„жҳҜ
з”ЁзЎ«еҸҠе…¶еҢ–еҗҲзү©еҲ¶зЎ«й…ёжңүдёӢеҲ—дёүз§ҚеҸҚеә”йҖ”еҫ„пјҢжҹҗдәӣеҸҚеә”жқЎд»¶е’Ңдә§зү©е·ІзңҒз•ҘпјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
йҖ”еҫ„в‘ пјҡ 
йҖ”еҫ„в‘Ўпјҡ 
йҖ”еҫ„в‘ўпјҡ 
A . йҖ”еҫ„в‘ зҡ„еҸҚеә”дёӯдҪ“зҺ°дәҶжө“ 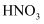 зҡ„ејәж°§еҢ–жҖ§
B . йҖ”еҫ„в‘ЎгҖҒв‘ўзҡ„第дәҢжӯҘеҸҚеә”еңЁе®һйҷ…з”ҹдә§дёӯеҸҜд»ҘйҖҡиҝҮеўһеӨ§
зҡ„ејәж°§еҢ–жҖ§
B . йҖ”еҫ„в‘ЎгҖҒв‘ўзҡ„第дәҢжӯҘеҸҚеә”еңЁе®һйҷ…з”ҹдә§дёӯеҸҜд»ҘйҖҡиҝҮеўһеӨ§  зҡ„жө“еәҰжқҘйҷҚдҪҺжҲҗжң¬
C . з”ұйҖ”еҫ„в‘ гҖҒв‘ЎгҖҒв‘ўеҲҶеҲ«еҲ¶еҸ–
зҡ„жө“еәҰжқҘйҷҚдҪҺжҲҗжң¬
C . з”ұйҖ”еҫ„в‘ гҖҒв‘ЎгҖҒв‘ўеҲҶеҲ«еҲ¶еҸ– 
 пјҢзҗҶи®әдёҠеҗ„ж¶ҲиҖ—
пјҢзҗҶи®әдёҠеҗ„ж¶ҲиҖ—  SпјҢеҗ„иҪ¬з§»
SпјҢеҗ„иҪ¬з§» 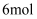
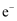 D . йҖ”еҫ„в‘ЎгҖҒв‘ўжҜ”йҖ”еҫ„в‘ жұЎжҹ“зӣёеҜ№е°Ҹдё”еҺҹеӯҗеҲ©з”ЁзҺҮй«ҳпјҢжӣҙиғҪдҪ“зҺ°вҖңз»ҝиүІеҢ–еӯҰвҖқзҡ„зҗҶеҝө
D . йҖ”еҫ„в‘ЎгҖҒв‘ўжҜ”йҖ”еҫ„в‘ жұЎжҹ“зӣёеҜ№е°Ҹдё”еҺҹеӯҗеҲ©з”ЁзҺҮй«ҳпјҢжӣҙиғҪдҪ“зҺ°вҖңз»ҝиүІеҢ–еӯҰвҖқзҡ„зҗҶеҝө
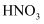 зҡ„ејәж°§еҢ–жҖ§
B . йҖ”еҫ„в‘ЎгҖҒв‘ўзҡ„第дәҢжӯҘеҸҚеә”еңЁе®һйҷ…з”ҹдә§дёӯеҸҜд»ҘйҖҡиҝҮеўһеӨ§
зҡ„ејәж°§еҢ–жҖ§
B . йҖ”еҫ„в‘ЎгҖҒв‘ўзҡ„第дәҢжӯҘеҸҚеә”еңЁе®һйҷ…з”ҹдә§дёӯеҸҜд»ҘйҖҡиҝҮеўһеӨ§  зҡ„жө“еәҰжқҘйҷҚдҪҺжҲҗжң¬
C . з”ұйҖ”еҫ„в‘ гҖҒв‘ЎгҖҒв‘ўеҲҶеҲ«еҲ¶еҸ–
зҡ„жө“еәҰжқҘйҷҚдҪҺжҲҗжң¬
C . з”ұйҖ”еҫ„в‘ гҖҒв‘ЎгҖҒв‘ўеҲҶеҲ«еҲ¶еҸ– 
 пјҢзҗҶи®әдёҠеҗ„ж¶ҲиҖ—
пјҢзҗҶи®әдёҠеҗ„ж¶ҲиҖ—  SпјҢеҗ„иҪ¬з§»
SпјҢеҗ„иҪ¬з§» 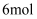
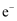 D . йҖ”еҫ„в‘ЎгҖҒв‘ўжҜ”йҖ”еҫ„в‘ жұЎжҹ“зӣёеҜ№е°Ҹдё”еҺҹеӯҗеҲ©з”ЁзҺҮй«ҳпјҢжӣҙиғҪдҪ“зҺ°вҖңз»ҝиүІеҢ–еӯҰвҖқзҡ„зҗҶеҝө
D . йҖ”еҫ„в‘ЎгҖҒв‘ўжҜ”йҖ”еҫ„в‘ жұЎжҹ“зӣёеҜ№е°Ҹдё”еҺҹеӯҗеҲ©з”ЁзҺҮй«ҳпјҢжӣҙиғҪдҪ“зҺ°вҖңз»ҝиүІеҢ–еӯҰвҖқзҡ„зҗҶеҝө
2019е№ҙиҜәиҙқе°”еҢ–еӯҰеҘ–жҺҲдәҲдәҶй”ӮзҰ»еӯҗз”өжұ ејҖеҸ‘зҡ„дёүдҪҚ科еӯҰ家гҖӮдёҖз§Қй”ӮзҰ»еӯҗз”өжұ зҡ„еҸҚеә”ејҸдёә  е…¶е·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—е……з”өз”өи§Јж¶ІиҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
е…¶е·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—е……з”өз”өи§Јж¶ІиҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
 е…¶е·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—е……з”өз”өи§Јж¶ІиҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
е…¶е·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—е……з”өз”өи§Јж¶ІиҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү 
A . е……з”өж—¶пјҢAжһҒжҺҘеӨ–з”өжәҗзҡ„жӯЈжһҒ
B . ж”ҫз”өж—¶пјҢиӢҘиҪ¬з§»  з”өеӯҗпјҢзҹіеўЁз”өжһҒе°ҶеҮҸйҮҚ
з”өеӯҗпјҢзҹіеўЁз”өжһҒе°ҶеҮҸйҮҚ  C . е……з”өж—¶BжһҒз”өжһҒејҸдёәпјҡ
C . е……з”өж—¶BжһҒз”өжһҒејҸдёәпјҡ  D . иҜҘеәҹж—§з”өжұ иҝӣиЎҢвҖңж”ҫз”өеӨ„зҗҶвҖқжңүеҲ©дәҺй”ӮеңЁBжһҒеӣһ收
D . иҜҘеәҹж—§з”өжұ иҝӣиЎҢвҖңж”ҫз”өеӨ„зҗҶвҖқжңүеҲ©дәҺй”ӮеңЁBжһҒеӣһ收
 з”өеӯҗпјҢзҹіеўЁз”өжһҒе°ҶеҮҸйҮҚ
з”өеӯҗпјҢзҹіеўЁз”өжһҒе°ҶеҮҸйҮҚ  C . е……з”өж—¶BжһҒз”өжһҒејҸдёәпјҡ
C . е……з”өж—¶BжһҒз”өжһҒејҸдёәпјҡ  D . иҜҘеәҹж—§з”өжұ иҝӣиЎҢвҖңж”ҫз”өеӨ„зҗҶвҖқжңүеҲ©дәҺй”ӮеңЁBжһҒеӣһ收
D . иҜҘеәҹж—§з”өжұ иҝӣиЎҢвҖңж”ҫз”өеӨ„зҗҶвҖқжңүеҲ©дәҺй”ӮеңЁBжһҒеӣһ收
и®ҫ  иЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
иЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 иЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
иЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A .  иӢҜд№ҷзғҜеҗ«жңүзўізўіеҸҢй”®ж•°дёә
иӢҜд№ҷзғҜеҗ«жңүзўізўіеҸҢй”®ж•°дёә  B .
B .  жә¶ж¶Іеҗ«ж•°дёә
жә¶ж¶Іеҗ«ж•°дёә  C . еңЁж ҮеҮҶзҠ¶еҶөдёӢпјҢ
C . еңЁж ҮеҮҶзҠ¶еҶөдёӢпјҢ 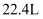 ж°–ж°”жүҖеҗ«еҺҹеӯҗж•°дёә
ж°–ж°”жүҖеҗ«еҺҹеӯҗж•°дёә  D .
D .  е®Ңе…ЁдёҺ
е®Ңе…ЁдёҺ  еҸҚеә”з”ҹжҲҗ
еҸҚеә”з”ҹжҲҗ  е’Ң
е’Ң 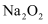 ж—¶иҪ¬з§»з”өеӯҗж•°дёә
ж—¶иҪ¬з§»з”өеӯҗж•°дёә 
 иӢҜд№ҷзғҜеҗ«жңүзўізўіеҸҢй”®ж•°дёә
иӢҜд№ҷзғҜеҗ«жңүзўізўіеҸҢй”®ж•°дёә  B .
B .  жә¶ж¶Іеҗ«ж•°дёә
жә¶ж¶Іеҗ«ж•°дёә  C . еңЁж ҮеҮҶзҠ¶еҶөдёӢпјҢ
C . еңЁж ҮеҮҶзҠ¶еҶөдёӢпјҢ 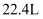 ж°–ж°”жүҖеҗ«еҺҹеӯҗж•°дёә
ж°–ж°”жүҖеҗ«еҺҹеӯҗж•°дёә  D .
D .  е®Ңе…ЁдёҺ
е®Ңе…ЁдёҺ  еҸҚеә”з”ҹжҲҗ
еҸҚеә”з”ҹжҲҗ  е’Ң
е’Ң 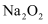 ж—¶иҪ¬з§»з”өеӯҗж•°дёә
ж—¶иҪ¬з§»з”өеӯҗж•°дёә 
дёӢеҲ—е…ідәҺеҸҚеә”  зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . SеҸӘдҪңж°§еҢ–еүӮ
B . NaOHдҪңиҝҳеҺҹеүӮ
C . ж°§еҢ–жҖ§пјҡSпјңNa2SO3
D . иў«ж°§еҢ–зҡ„е…ғзҙ е’Ңиў«иҝҳеҺҹзҡ„е…ғзҙ зҡ„иҙЁйҮҸд№ӢжҜ”дёә1вҲ¶2
жңҖиҝ‘жӣҙж–°



