专题3 从海水中获得的化学物质 知识点题库
-
(1) I.双氧水(主要成分H2O2)是常见的氧化剂、还原剂。
如下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式。
-
(2) H2O2可看作二元弱酸,写出它在水中第一步电离的方程式。
-
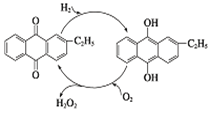
(3) II.A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。

若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式: 。
-
(4) 若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为(填代号)。
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.Na[Al(OH)4]
-
(5) 若A为淡黄色粉末,则A的电子式为。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为(填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
-
(6) 若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为,E是(填化学式)。
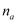 是阿伏加德罗常数的值,下列说法错误的是( )
是阿伏加德罗常数的值,下列说法错误的是( )
 含有的中子数为1
含有的中子数为1 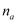 B .
B . 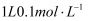 磷酸钠溶液含有的
磷酸钠溶液含有的  数目为0.1
数目为0.1 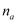 C .
C .  被还原为
被还原为  转移的电子数为6
转移的电子数为6 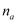 D . 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13
D . 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13 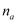
①NaOH溶液和H2SO4溶液:;
②NaCl溶液和AgNO3溶液:;
③Ba(OH)2溶液和H2SO4溶液:;
④Fe与CuSO4溶液反应:;
⑤Na2CO3溶液与Ca(OH)2溶液反应:。
①Al2O3(作耐火坩埚) ②KAl(SO4)2·12H2O(作消毒剂)③Fe2O3(作黄色油漆和涂料) ④NaHCO3(作食用碱) ⑤钠、钾、锶、钡等化合物(作烟花的焰色) ⑥Na2O2(作呼吸面具供氧剂)
-
(1) NaHCO3能用于治疗胃酸过多,反应的离子方程式为。
-
(2) 铁和水蒸气反应的化学方程式为3Fe+4H2O(g)
 Fe3O4+4H2 , 该反应中84g Fe参加反应,转移电子的物质的量为。
Fe3O4+4H2 , 该反应中84g Fe参加反应,转移电子的物质的量为。
-
(3) 制备Fe(OH)3的实验操作:向煮沸的蒸馏水中加入几滴FeCl3溶液,。
-
(4) 密度为1.84g/cm3 , 质量分数为98%的浓硫酸的物质的量浓度为。
 H3O++S2-
B . HS-+H+=H2S
C . CO32-+2H2O
H3O++S2-
B . HS-+H+=H2S
C . CO32-+2H2O  H2CO3+2OH-
D . Fe3++3H2O
H2CO3+2OH-
D . Fe3++3H2O  Fe(OH)3+3H+
Fe(OH)3+3H+
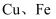 和
和  ,此外还含有少量
,此外还含有少量  和
和  。为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的废料抽取氯化铝、绿矾
。为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的废料抽取氯化铝、绿矾  和胆矾晶体。
和胆矾晶体。 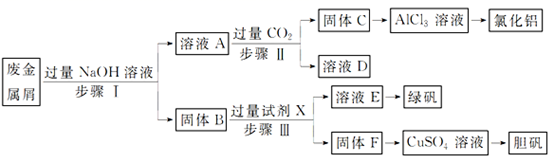
请回答:
-
(1) 写出步骤Ⅰ反应的离子方程式:;;
-
(2) 试剂X是,溶液D是;
-
(3) 在步骤Ⅱ时,用如图所示装置制取
 并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是;
并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是; 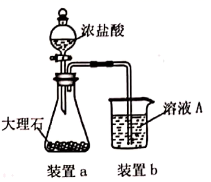
-
(4) 工业上常用溶液E制得净水剂
 ,流程如下:
,流程如下: 
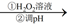
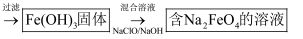
①测得溶液E中
 为
为  ,若要处理
,若要处理  溶液E,理论上需要消耗25%的
溶液E,理论上需要消耗25%的  溶液
溶液 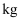 ;
;②写出由
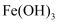 制取
制取  的离子方程式(已知
的离子方程式(已知  被还原为
被还原为  )。
)。
-
(1) (实验1)配制砷标准溶液
①取0.132gAs2O3 , 用NaOH溶液完全溶解后,配制成1LNa3AsO3溶液(此溶液1mL相当于0.10mg砷)。
②取一定量上述溶液,配制1L含砷量为1mg•L-1的砷标准溶液。
步骤①中,必须使用的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需。步骤②需取用步骤①中Na3AsO3溶液mL。
-
(2) (实验2)制备砷标准对照液(实验装置如图,夹持装置已略去)
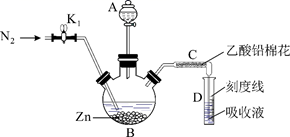
①往B瓶中加入2.00mL砷标准溶液,再依次加入一定量的盐酸、KI试液和SnCl2溶液,室温放置10min,使砷元素全部转化为H3AsO3。
②往B瓶中加入足量锌粒(含有ZnS杂质),立即塞上装有乙酸铅棉花的导气管C,并使C管右侧末端插入比色管D中银盐吸收液的液面下,控制反应温度25~40℃。45min后,生成的砷化氢气体被完全吸收,Ag+被还原为红色胶态银。
③取出C管,在D中添加氯仿至刻度线,混匀,得到砷标准对照液。
乙酸铅棉花的作用是。
-
(3) 完成生成砷化氢反应的离子方程式:。
Zn+H3AsO3+H+=( )+Zn2++( )
-
(4) 控制B瓶中反应温度的方法是;反应中,通入N2的作用是。
-
(5) C管右侧末端导管口径不能过大(一般为1mm),原因是。
-
(6) (实验3)判断样品中砷含量是否超标
称取ag明矾样品替代(实验2)①中“2.00mL砷标准溶液”,重复(实验2)后续操作。对比实验2、3比色管D中液体的颜色,若实验3中液体颜色浅,说明该样品含砷量未超标,反之则超标。
国标规定砷限量为百万分之二(质量分数)。实验测得明矾样品中砷的含量恰好达标,则a的值为g。

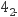 =BaSO4↓
C . 氧化钙与稀盐酸反应:CaO+2H+=H2O+Ca2+
D . 醋酸与氢氧化钾:H++OH¯=H2O
=BaSO4↓
C . 氧化钙与稀盐酸反应:CaO+2H+=H2O+Ca2+
D . 醋酸与氢氧化钾:H++OH¯=H2O
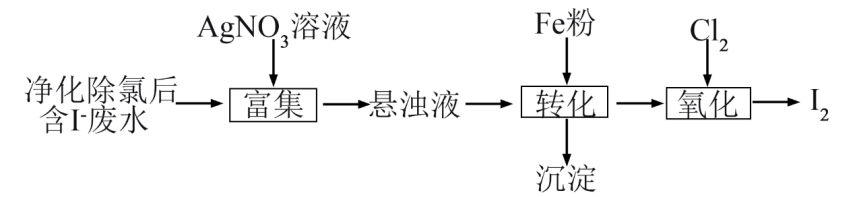
下列说法不正确的是( )
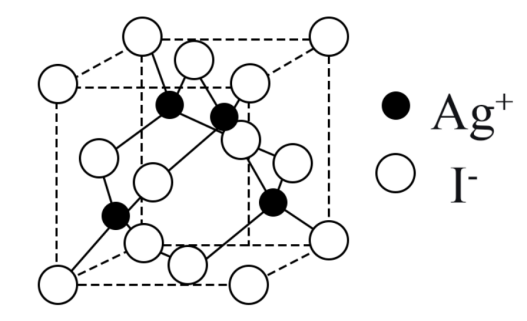

下列说法正确的是( )
 等)通过物理方法即可转为精盐
B . 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C . 在第③步中可通入Cl2使溴离子被还原为Br2
D . 在第④步中,SO2水溶液吸收Br2后,溶液的pH减小
等)通过物理方法即可转为精盐
B . 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C . 在第③步中可通入Cl2使溴离子被还原为Br2
D . 在第④步中,SO2水溶液吸收Br2后,溶液的pH减小



