第一单元 含硫化合物的性质 知识点题库
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,现有下列三种硫酸溶液,应选用 (填字母),理由是 ;
A.98%浓硫酸B.70%硫酸C.10%稀硫酸
(2)为了探究SO2能否使品红褪色,该同学选择了正确的药品后设计了如图所示实验装置,请指出实验装置设计中的不合理之处.
① ;② .
(3)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.为此,你认为使品红的水溶液褪色的微粒可能是 .
(4)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出的结论:使品红褪色的微粒肯定是HSO3﹣或SO32﹣ . 你认为他的结论是否正确 , 其理由是 .

-
(1) 不需要加热的有;
-
(2) 需要水浴的有;
-
(3) 需要用温度计的有;其中温度计插入反应液的有;
-
(4) 需要加碎瓷片的有;
-
(5) 反应中必须加入浓H2SO4的有.
选项 | X | Y | Z |
A | SO2 | NaClO溶液 | CO2 |
B | 盐酸 | 浓硫酸 | Cu |
C | NH3 | O2 | Mg |
D | Na2O2 | H2O | SiO2 |


-
(1) 从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有(填化学式).
-
(2) 将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为.
-
(3) Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为.
-
(4) Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
-
(5) 已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05mol•L﹣1的Na2SO3溶液与 20mL 0.02mol•L﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为.
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠⑥双氧水

-
(1) 该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2 , 采用MnO2和浓盐酸(12mo1·L-1)为原料制取Cl2。在此实验中,F仪器的作用是;发生装置B应选择以下三种装置的(填序号),发生反应的化学方程式是 。

-
(2) D装置中主要反应的离子方程式为。
-
(3) 为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液②氯化亚铁溶液③硫氰化钾溶液④酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内;再加入(选填一个序号)试剂。发生的现象是 。
若SO2过量,取适量D中溶液滴加至盛有(选填一个序号)试剂的试管内,发生的现象是 。

 的值始终减小
的值始终减小
-
(1) 实验室合成SOCl2的原理之一为SO2+Cl2+SCl2
 2SOCl2 , 部分装置(夹持、加热装置略去)如图所示。
2SOCl2 , 部分装置(夹持、加热装置略去)如图所示。 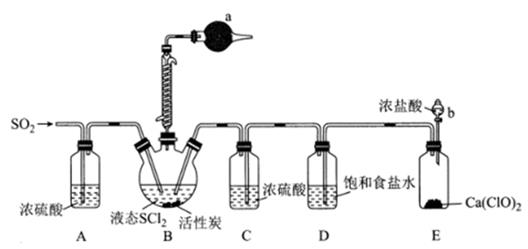
①实验室用亚硫酸钠固体与70%硫酸制备SO2 , 不用稀硫酸的原因为。
②装置A、C除干燥气体外,另一作用是;装置D的作用为。
③仪器b的名称为;写出装置 E中发生反应的化学方程式:。
④仪器a中的试剂为。
-
(2) 甲同学设计实验利用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3。
①用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3时,SOCl2的作用为。
②实验室常用过量NaOH溶液吸收SOCl2 , 写出反应的离子方程式:。
 气体的还原性,下列说法错误的是( )
气体的还原性,下列说法错误的是( )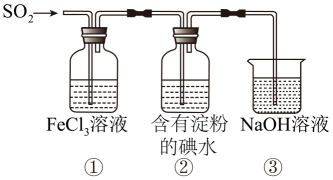
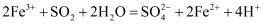 B . ①中加入
B . ①中加入 溶液,紫红色褪去,可说明
溶液,紫红色褪去,可说明 与
与 发生了氧化还原反应
C . ②中蓝色溶液褪色的现象能表明
发生了氧化还原反应
C . ②中蓝色溶液褪色的现象能表明 的还原性强于
的还原性强于 D . 装置③的作用是吸收
D . 装置③的作用是吸收 尾气,防止污染空气
尾气,防止污染空气



