溶质的质量分数及相关计算 知识点题库
将70℃的硝酸钠饱和溶液降温到10℃,有晶体析出(晶体中不含水),下列各量没有发生变化的是( )
A . 硝酸钠的溶解度
B . 溶液中溶质的质量
C . 溶液中溶剂的质量
D . 溶液中溶质的质量分数
有一包只含有Na2CO3和NaHCO3的混合物,为了测定其含量,技术员小颖取19g样品放入烧杯中,加入100g水充分溶解后,逐滴滴入稀盐酸并不断搅拌,至B点时恰好完全反应.测出烧杯内溶液的总质量与加入稀盐酸质量的关系曲线如图所示(反应生成的气体全部逸出).
已知,Na2CO3与HCl反应分两步进行:第一步反应:Na2CO3+HCl=NaCl+NaHCO3
第二步反应:NaHCO3+HCl=NaCl+H2O+CO2↑

求:
-
(1) 图中AB段表示第 步反应;反应后生成的CO2质量是 g.
-
(2) 所加入的稀盐酸中溶质质量分数是多少?
-
(3) 样品中NaHCO3的质量是多少?
烧杯中盛有BaCl2和HCl液100.0g,向其中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示.下列说法正确的是( )

A . ab段产生白色沉淀
B . bc段溶液质量增加86.3g
C . c点对应溶液的溶质质量分数为7.5%
D . 向d点溶液中滴加酚酞试液,溶液显红色
甲、乙两物质的溶解度曲线如图2所示.现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯里,然后向烧杯中加入适量的氢氧化钠固体,搅拌至完全溶解(如图1),此时对相应变化的判断正确的是( )
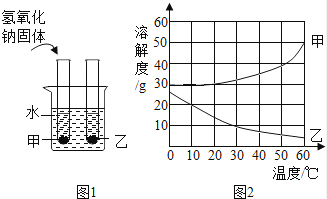
A . 甲溶液可能变成不饱和溶液
B . 盛乙的试管中未溶解的固体质量减少
C . 甲、乙两物质的溶解度都增大
D . 乙溶液中溶质质量分数减小
现有Mg和MgO的固体混合物3g,经测定镁元素的质量分数为80%,向固体混合物中加入100g一定溶质质量分数的稀盐酸,恰好完全反应,下列说法错误的是( )
A . 反应过程中有气泡产生
B . 生成MgCl2的质量为9.5g
C . 所用稀盐酸中溶质的质量分数为14.6%
D . 反应后溶液中的溶质只有MgCl2
下列图象中有关量的变化趋势正确的是( )
A . 某温度下,向一定量不饱和硝酸钾溶液中不断加入硝酸钾晶体
B . 向一定量的稀盐酸中逐滴滴加水
B . 向一定量的稀盐酸中逐滴滴加水
C . 向一定量的氢氧化钠和碳酸钠的混合溶液中逐滴滴加盐酸
C . 向一定量的氢氧化钠和碳酸钠的混合溶液中逐滴滴加盐酸
D . 将水通电电解一段时间
D . 将水通电电解一段时间

B . 向一定量的稀盐酸中逐滴滴加水
B . 向一定量的稀盐酸中逐滴滴加水
C . 向一定量的氢氧化钠和碳酸钠的混合溶液中逐滴滴加盐酸
C . 向一定量的氢氧化钠和碳酸钠的混合溶液中逐滴滴加盐酸
D . 将水通电电解一段时间
D . 将水通电电解一段时间
向26.4 g硫酸钠和碳酸钠的混合物中滴加硫酸溶液,直到不再产生气体为止(假设气体全部逸出),共用去98g质量分数为10%的硫酸溶液。求:
①原混合物中碳酸钠的质量。
②反应后溶液中溶质的质量分数。
在一烧杯中盛有100gBaCl2和HCl的混合溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,混合溶液的质量与所滴入的Na2CO3溶液的质量关系图像如图所示.

-
(1) 在实验过程中,有气体放出,还可以看到的明显实验现象是.
-
(2) 原溶液中HCl的质量分数为多少?
-
(3) 当滴入Na2CO3溶液至图中B点时,通过计算求所得不饱和溶液中溶质质量分数为多少?(计算结果精确到0.1%)
酿制白酒的原料一般用高粱、大米或小麦等,需要经过煮熟、发酵、蒸馏、配制四个主要的步骤。
-
(1) 发酵过程是利用微生物的呼吸把有机物分解为酒精和二氧化碳。例如葡萄糖的分解反应方程式为:C6H12O6
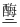 2CO2↑+2。(请填入化学式)
2CO2↑+2。(请填入化学式)
-
(2) 蒸馏(步骤)是将酒精从发酵后的混合液中分离出来的过程,该过程利用了不同液体的 不同的物理性质。
-
(3) 若现有一份质量分数为60%的白酒(高度),用水蒸馏水稀释成720kg的40%的低度酒,稀释过程中加入多少L水?
-
(4) “酒后开车”往往会带来安全隐患,因为酒精进入人体的血液循环后损坏神经系统中控制运动协调性的。
2016 年 9 月 28 日,“鲶鱼”台风带来大风强降雨,造成很多道路积水严重,最深达到 2 米,造成经济损失严重。


-
(1) 台风过后,河道里出现大量漂浮物,为清理河道,河道管理人员使用铁圈和塑料网做成的网兜(如图)来打捞河道漂浮物,这种方法最接近 。A . 沉淀 B . 过滤 C . 蒸馏 D . 结晶
-
(2) 受强台风影响,温州市某些沿海地方的水厂受淹,市民用水困难,为了解决缺水问题。暂时采用海水淡化技术,该技术(原理如图所示)采用对海水加压,海水中的溶剂分子可以通过半透膜,而溶质分子很难透过。海水淡化过程中,浓海水中溶质质量分数将。
6.5克锌与100克稀硫酸混合,得到无色溶液。
-
(1) 若二者恰好完全反应,则在100克稀硫酸中溶质的化学式为,其质量为g,溶剂的的化学式为,其质量为g,完全反应后,所得溶液的质量为g,其中溶质的化学式为,其质量为g,溶剂的的化学式为,其质量为g
-
(2) 若锌完全反应,则所得溶液中溶质的化学式为。
向含CuCl2和HCl的100g混合溶液中,逐滴加溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图[仅考虑沉淀为Cu(OH)2]。求:

-
(1) P点溶液中含有的溶质是(写出化学式);
-
(2) 图像中,m1=。
-
(3) 计算M点时溶液中溶质的质量分数 (要求写出计算过程,结果保留到0.1%)。
自然界的水都是含有多种物质的混合物,生产、生活中需要的纯净水可以通过蒸馏得到。
-
(1) 将刚刚蒸馏出来的蒸馏水盛放在敞口的干净容器里,一段时间后,蒸馏水的pH将发生怎样的变化?
请你分析说明引起蒸馏水pH改变的原因。
-
(2) 在电解水的实验中,为了增加水的导电性,常在水中加入一定量的稀硫酸。某次实验时,在一定量的蒸馏水中加入50克16%的稀硫酸进行电解,结束后测得剩余溶液的质量为100克,则剩余溶液中溶质的质量分数为多少?
要将100g溶质质量分数为10%的氯化钠溶液达到质量分数为20%,可采用的方法是( )
A . 加入10g氯化钠
B . 蒸发掉45g水
C . 蒸发掉50g水
D . 加入10.5g氯化钠
小红同学通过查阅资料得到氧化钙俗名生石灰,遇水会反应生成氢氧化钙,同时会放出大量的热,氢氧化钙的水溶液俗称石灰水,而氢氧化钙是微溶于水,它的溶解度随温度的升高而减小.

①开始时,溶液中溶质的质量分数减少的原因是;
②室温下,最终溶液中溶质质量分数与原溶液溶质的质量分数相比将(填“变大”“变小”或“不变”).
如图,用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )

A . 甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B . 甲实验各步操作中,玻璃棒的作用都是相同的
C . 乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(ρ水 =1g/cm3)
D . 乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如下:

资料:①Fe2(SO4)3+Fe=3FeSO4;②硫酸亚铁容易被氧化为硫酸铁等物质。
-
(1) 配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为98%的浓硫酸克。
-
(2) 写出该实验中的一条化学方程式(除资料①中的反应外)。
-
(3) 稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目的是。
如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )

A . 甲物质的溶解度大于乙物质的溶解度
B . t1℃时,100g水最多溶解甲物质的质量和最多溶解乙物质的质量相等
C . t2℃时,甲物质溶液中溶质质量分数比乙物质溶液中溶质质量分数大
D . 将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,均无晶体析出
20℃时,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示 ,有关说法错误的是( )
| 物质 | 甲 | 乙 | 丙 |
| 未溶解固体的质量/g | 7 | 0 | 3 |
A . 所得溶液一定都是饱和溶液
B . 三种溶液中,溶质的质量分数乙>丙>甲
C . 升高温度,物质乙的质量分数可能不变
D . 20℃时,甲的溶解度最小
在实验室中,小宁同学发现了一瓶敞口的氢氧化钠固体。他对该固体的成分进行了定量实验分析:称取固体28 g放入锥形瓶中,加入一定量的水配制成50g溶液,再向锥形瓶中依次滴加30g溶质质量分数为14.6%的盐酸充分反应,测得部分数据如表。请根据有关信息回答问题。
|
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
第7次 |
|
加入盐酸的质量/g |
30 |
30 |
30 |
30 |
30 |
30 |
30 |
|
锥形瓶中物质的质量/g |
80 |
110 |
140 |
170 |
197.8 |
226.7 |
a |
-
(1) a的数值为。
-
(2) 计算氢氧化钠固体中碳酸钠的质量分数(计算结果精确到0.1%)
-
(3) 计算第5次加入盐酸后,氯化钠的质量分数。(计算结果精确到0.1%)
最近更新



