同位素 知识点题库
 Ho可有效地治疗肝癌.该同位素原子内中子数为( )
Ho可有效地治疗肝癌.该同位素原子内中子数为( )
①液氧②3517 Cl③白磷④氧气⑤红磷⑥1737C.

-
(1) 涉及的核素共有种;
-
(2) 互为同位素的是;
-
(3) 质量数相等,但不能互称为同位素的是;
-
(4) 中子数相等,但质子数不相等的是.
A.同种物质 B.同位素 C.同系物 D.同素异形体 E.同分异构体
-
(1) 正丁烷和异丁烷,
-
(2) 红磷和白磷,
-
(3) 甲烷和乙烷,
-
(4) 氕、氘、氚.
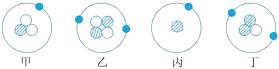

-
(1) 三种粒子相对原子质量不同的原因。
-
(2) 由此你可以得出的结论是。
|
组别 |
质子 |
中子 |
电子 |
|
A |
14 |
14 |
14 |
|
B |
26 |
30 |
24 |
|
C |
26 |
30 |
26 |
|
D |
14 |
16 |
14 |
-
(1) 18O和16O属于同位素原子,它们的原子结构中 相同。A . 质子数 B . 中子数 C . 电子数 D . 核电荷数
-
(2) 根据实验结论,在虚线框内补充第三次实验碳酸氢盐和氧气中18O百分比的条形图。
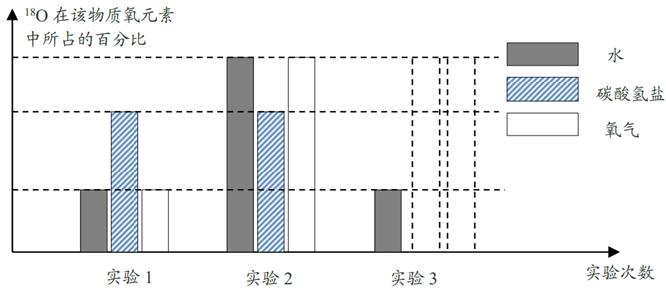
-
(3) 鲁宾和卡门是通过测量生成氧气的密度确定氧气中18O的含量。如果有一种氧气,18O占50%,即18O和16O的个数比为1:1。根据以下资料计算,在标准状况下该种氧气的密度为kg/m3。(保留两位小数)
资料:I.在相同的温度和压强下,相同体积的气体具有相同的分子数。
II.18O的相对原子量为 18,16O的相对原子量为 16。
III.自然界的氧气在标准状况下的密度为1.43 kg/m3 , 16O 占所有氧原子的比例可近似看作 100%。
|
组别 |
质子 |
中子 |
电子 |
|
A |
14 |
14 |
14 |
|
B |
26 |
30 |
24 |
|
C |
26 |
30 |
26 |
|
D |
14 |
16 |
14 |
|
微粒名称 |
质子数 |
中子数 |
电子数 |
带电性 |
|
A |
14 |
14 |
14 |
不带电 |
|
B |
26 |
30 |
24 |
带2个单位正电荷 |
|
C |
14 |
14 |
16 |
|
|
D |
14 |
16 |
14 |
不带电 |
-
(1) 表格中属于互为同位素的是。
-
(2) 根据表格信息写出微粒C的符号。
-
(3) 比较C与D两种微粒,其中质量较大的是。
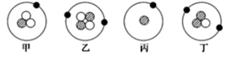

-
(1) 进入月球轨道后,载有上升器的着陆器会择机着陆月面,按计划开展自动采样工作。
①者陆前,着陆器会在月面上空不停拍照,将信息输送给控制系统,由后者进行对比分析并确定最佳落月点,最后发出着陆指令。“控制系统”相当于人体反射弧中的(选填字母)
A.感受器
B.神经中枢
C.传出神经
D.效应器
②着陆器采用喷气式减速着陆。着陆过程中,着陆器应该(选填“正向”或“背向”)月面喷气。
③着陆后,着陆器采用表钻结合的方式,既铲挖了月面表层土壤,又深孔钻取了月面至2米深处的“月壤柱”,样品对研究月球地质演化历史更有价值(选填“表面土壤”或“月壤柱")。
-
(2) 目前航空界公认的月壤平均密度约为1.6g/cm3 , 科学家据此为嫦娥五号设计了最多能装2kg月壤的收集容器。但本次带回来的月壤样品虽然装满容器,质量却仅有1731g,求该月壤样品的密度。(结果保留两位小数)
-
(3) 科学家计划在月球上建立永久基地,并为人类登陆其它行星做好前期准备。月壤里含有丰富的资源,尤其是可用于可控核聚变的燃料
 和钛铁矿(主要成分是FTiO3)。
和钛铁矿(主要成分是FTiO3)。
①地球上,氦元素主要以
 的形式存在。
的形式存在。  和
和  (填“属于”或“不属于”)同种元素,
(填“属于”或“不属于”)同种元素,  和
和  的区别是。
的区别是。②科学家设想用图乙流程来解决基地人员的供氧问题,同时获得飞船建造所需材料Ti。由图乙可以获得的正确结论有。
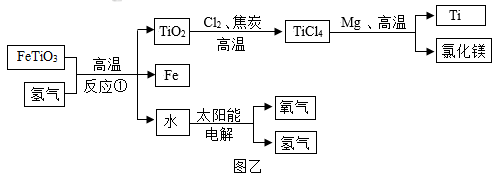
A.本流程中氢气可以循环利用
B.反应①的化学方程式为:FeTiO3+H2
 Fe+TiO2+H2O
Fe+TiO2+H2OC.Ti的金属活动性强于Mg
D.在TiO2转化为TiCl4时,发生了化合反应
③火星与地球、火星与月球间的距离非常接近。未来,我国可在月球基地发射火星探测器——“天问N号”,与在地球发射相比,运载火箭携带的燃料将大幅减少,请从能量的角度予以解释:。

|
名称 |
符号 |
相对原子质量 |
| 氕 |
H |
1 |
| 氘 |
D |
2 |
| 氚 |
T |
3 |
-
(1) 原子结构模型中的“
 ”表示的粒子是。
”表示的粒子是。
-
(2) 超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O。T2O中T的化合价为。
-
(3) 重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100吨海水中所含氘的质量是多少?
-
(1) 同位素Li-6和Li-7原子核内中子数分别为;
-
(2) 水(H2O)、双氧水(H2O2)、重水(D2O)(“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从化学性质的角度看,(填化学式)与H2O的化学性质有较大差异,原因是。
|
组别 |
质子 |
中子 |
电子 |
|
A |
14 |
14 |
14 |
|
B |
26 |
30 |
24 |
|
C |
26 |
30 |
26 |
|
D |
14 |
16 |
14 |



