同位素 知识点题库
化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,则1735Cl和1737Cl( )
A . 属于同种元素
B . 原子核内质子数不同
C . 原子中核外电子数不同
D . 原子中含有相同数目的中子
用化学方法不能实现的是( )
A . 生成一种新分子
B . 生成一种新离子
C . 生成一种新同位素
D . 生成一种新单质
1999年俄、美科学家联合小组合成了第114号元素的一种同位素,该核素原子的质量数为298,则这种同位素原子的核内中子数为,核内质子数为.
已知氧元素有16 O、18O两种同位素,碳元素有12C、13C、14C三种同位素,这五种微粒构成CO2分子,其分子种类可能有种,相对分子质量可能有种.
下列各组中互为同位素的是( )
A . 重氢、超重氢
B . 氧气、臭氧
C . 金刚石、石墨
D . 水、重水
 Rn、
Rn、  Rn是( )
Rn是( )
A . 两种元素
B . 互为同位素
C . 同种核素
D . 同一原子
科学上常用元素符号左下角数字表示原子的质子数,左上角数字表示原子的中子数与质子数之和,如 613C表示核内有6个质子和7个中子的碳原子。下列关于 53131I和 53127I的说法中错误的是( )
A . 各取一个原子相比较,中子数相同
B . 属于同种元素
C . 各取一个原子相比较,核外电子数相同
D . 各取一个原子相比较,质子数相同
以下有关同位素说法错误的是( )
A . 同种元素的各种同位素原子的化学性质基本相同,但它们的其他性质有很大差别
B . 大多数元素都有同位素原子,氢有氕(H)、氘(H)、氚(H)3 种同位素原子
C . 互为同位素的原子,质子数和核外电子数一定相等,中子数一定不相等
D . 金刚石和石墨都是由碳原子构成的,它们互为同位素原子
22岁的中国在读博士生曹原被评为2018年度影响世界的十大科学人物并名列首位。因为他发现了让石墨烯实现超导的方法,为超导材料的研究打开了一片新天地。石墨烯是从石墨中分离出来的一层或几层碳原子构成的石墨片,下列相关说法正确的是( )
A . 石墨烯属于无机化合物
B . 石墨烯和金刚石互为同位素
C . 超导体材料最适合用来做电热器中的发热体
D . 用超导体进行远距离输电可以大大增加输电效率
如图所示代表三种原子的原子核,请回答下列问题:

这三种原子的原子核内均含有个质子,所以它们属于同种_,但中子数不同,它们是氢的。
简单原子的原子结构可用下图形象地表示,其中“  ”表示质子或电子,“
”表示质子或电子,“  ”表示中子,则下列有关①②③的叙述正确的是( )
”表示中子,则下列有关①②③的叙述正确的是( )

A . ①②③分别为氢、氦、锂的原子
B . ①②③互为同位素
C . ①②③是三种化学性质不同的离子
D . ①②③具有相同的相对原子质量
下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。
|
粒子名称 |
质子数 |
中子数 |
电子数 |
|
A |
14 |
14 |
14 |
|
B |
26 |
30 |
24 |
|
C |
14 |
14 |
18 |
|
D |
14 |
18 |
14 |
-
(1) B微粒所带的电性为。(填“不带电”、“带正电”或“带负电”)
-
(2) 与A互为同位素原子的是。
在研究植物光合作用的实验中,某研究小组在密封的容器A中充入足量的含有同位素14C的14C O2。随着时间的推移,他们发现该植物的不同器官相继出现了同位素14C(如图甲,黑色部分表示检测到同位素14C的部位)。据此回答:

-
(1) 写出14CO2参加光合作用的场所。
-
(2) 14CO2主要通过图乙中结构进入叶片中;说说14C与图丙中哪个原子是同位素原子。
-
(3) 叶片中的14C主要是通过茎中的哪一部分结构送到该植物的根部。(选填“导管”或“筛管”)
用  分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
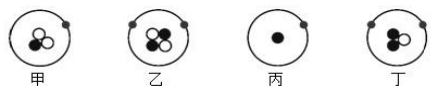
A . 甲、乙互为同位素
B . 乙、丁为同一种元素
C . 甲、丙的核电荷数不同
D . 丙、丁为同一种原子
如表是元素周期表的一部分,请回答下列问题

-
(1) 周期表中的①②③代表三种不同的元素,③是元素(填名称),属于非金属的是,属于同一周期的元素是(填序号)。
-
(2) 氕、氘、氚都属于表中的氢元素,原因是其原子的相同,但不同。
-
(3) 最近,科学家用大量高速钙原子轰击锫原子,形成了核电核数为117的元素的原子,该原子的核外电子数是 。
嫦娥五号带回的月球土壤中含有较丰富的氦-3,而在地球上氦元素主要以氦-4的形式存在,如图是它们的原子结构示意图,下列说法正确的是( )

A .  表示质子
B .
表示质子
B .  表示中子
C . 氦-3原子核内有两个电子
D . 氦-3与氦-4互为同位素
表示中子
C . 氦-3原子核内有两个电子
D . 氦-3与氦-4互为同位素
据日本媒体报道,日本政府计划将充分稀释后排入大海的方法,处理核废水中技术上无法去除的放射性物质“氚”,可以进入生物体内,还可以在体内停留,并引起基因突变。它的原子核由一个质子和二个中子组成。关于氚下列正确的是( )
A . 是Li的同位素
B . 这种氚原子和氧原子构成的水分子,其相对分子质量为20
C . 这种原子的核外电子数为2
D . 相对原子质量为3
表中①②③④是四种粒子,请填表并回答有关问题。
|
粒子序号 |
质子数 |
中子数 |
电子数 |
带电性 |
|
① |
14 |
14 |
14 |
|
|
② |
26 |
30 |
|
带2个单位正电荷 |
|
③ |
14 |
14 |
16 |
|
|
④ |
14 |
16 |
|
不带电 |
表中粒子属于阳离子的是(填序号,下同),属于阴离子的是,属于原子的是;属于同种元素;互为同位素原子。
据报道钬元素的原子  H可有效治疗肝癌, 该原子中的中子数与核外电子数之差是 ,现有
H可有效治疗肝癌, 该原子中的中子数与核外电子数之差是 ,现有  X和
X和  Y两种原子,我们把X和Y原子称之为 原子。
Y两种原子,我们把X和Y原子称之为 原子。
 H可有效治疗肝癌, 该原子中的中子数与核外电子数之差是 ,现有
H可有效治疗肝癌, 该原子中的中子数与核外电子数之差是 ,现有  X和
X和  Y两种原子,我们把X和Y原子称之为 原子。
Y两种原子,我们把X和Y原子称之为 原子。
氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图所示,相关信息如下表。试回答:
|
名称 |
符号 |
相对原子质量 |
|
氕 |
H |
1 |
|
氘 |
D |
2 |
|
氚 |
T |
3 |

-
(1) 原子结构模型中的“〇”表示的粒子是。
-
(2) 超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O,T2O中T的化合价为。
-
(3) 重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100吨海水中所含氘的质量是吨。
最近更新



