质量守恒定律及其应用 知识点题库
(1)新国标在无机物指标中修订了镉、铅等的限量.这里的镉、铅指的是 (填序号).
A.原子 B.分子 C.元素 D.单质
(2)新国标中对水的pH的规定为6.5≤pH≤8.5.实验室用pH试纸测得自来水的pH=8,说明该自来水显(填“酸”、“碱”或“中”)性.
(3)新国标中消毒剂由1项增至4项,加入了对用臭氧、二氧化氯和氯胺消毒的规定.
①臭氧(O3)在消毒过程中转化为氧气.臭氧转化为氧气属于(填“物理”或者“化学”)变化.
②二氧化氯消毒过程中产生的次氯酸根离子(ClO﹣)也有消毒作用.ClO﹣中氯元素的化合价为 价.
③氯胺(NH2Cl)由 (填数字)种元素组成.用氯胺消毒时,反应的化学方程式是NH2Cl+X=NH3+HClO,其中X的化学式为 .

实验次数 | 1 | 2 | 3 |
碳酸钠质量/克 | 0.53 | 1.06 | 2.12 |
反应前装置总质量/克 | 66.33 | 66.86 | 67.92 |
反应后装置总质量/克 | 66.19 | 66.62 | 67.42 |
-
(1) 计算第1次反应产生的二氧化碳质量。
-
(2) 分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)
-
(1) 该反应生成二氧化碳的质量为g;
-
(2) 原混合物中碳酸钠的质量.
-
(3) 反应后所得溶液中溶质的质量分数.

⑴阅读产品标签:“污渍爆炸盐”是一种衣物助洗剂,主要成分是过碳酸钠,能在瞬间去除洗衣液难以除去的多种顽固污渍……,本产品不伤衣物,无磷是它的一大优点。
⑵查阅资料:过碳酸钠(Na2CO4)是白色结晶颗粒,溶于水会产生碳酸盐和其它化合物。
⑶小明猜想其它化合物为:i.NaOH;ii.H2O2;iii.NaOH 和 H2O2;
⑷实验设计:探究“污渍爆炸盐”水溶液的成分,完成下列表格。
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤 1:取少量“污渍爆炸盐”于烧杯中,加入足量蒸馏水,充分搅拌。 | 固体完全溶解,形成无 色溶液 | / |
| 步骤 2:取少量步骤 1 形成的溶液于试管中,再加入氯化钙溶液,振荡,静置。 | ▲ | 含有 Na2CO3 |
| 步骤 3:取少量步骤 2 试管中的上层清液于另一支试管中,再滴加少量 MgCl2 溶液,振荡。 | 无明显现象 | ▲ |
| 步骤 4:另取一支试管,加入少量步骤 1 形成的溶液,再加入二氧化锰,将带火星木条伸入试管中。 | 带火星的木条复燃 | 含有 H2O2 |
请回答下列问题:
-
(1) 小明做出以上猜想的理论依据是;
-
(2) 根据步骤 2 的实验结论推测其实验现象是;
-
(3) 从步骤 3 实验现象可以得出的实验结论是;


-
(1) 在B图中将相关粒子图形补充完整。
-
(2) 此过程中发生变化的粒子是(写出具体微粒名称)。
-
(3) 结合该图,从微观角度解释由A到B变化的实质是什么?
| 甲 | 乙 | 丙 | |
| | | |
一定条件下,3.4g甲物质和4.8g氧气恰好完全反应,生成5.4g乙物质和另一种物质X,下列判断错误的是( )
|
实验次序 |
实验一 |
实验二 |
实验三 |
实验四 |
|
鸡蛋壳的质量/g |
10 |
10 |
10 |
10 |
|
加入盐酸的质量/g |
10 |
20 |
30 |
40 |
|
反应后溶液总质量/g |
18.9 |
m |
36.7 |
46.7 |
-
(1) 表格中m的数值为。
-
(2) 40g鸡蛋壳与足量的盐酸溶液反应,最多生成气体质量为g。
-
(3) 该鸡蛋壳中CaCO3的质量分数是多少?
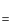 mCO2+nCO+16H2O。当反应物完全转化为生成物后,降至常温常压下,容器内余下的液体为7.2克。则系数x=,该反应生成CO2的质量为。
mCO2+nCO+16H2O。当反应物完全转化为生成物后,降至常温常压下,容器内余下的液体为7.2克。则系数x=,该反应生成CO2的质量为。
 Na2CO3+H2O+CO2↑),现取Na2CO3和NaHCO3的混合物40g,加热到质量不再改变为止,剩余固体质量为27.6g,下列说法正确的是( )
Na2CO3+H2O+CO2↑),现取Na2CO3和NaHCO3的混合物40g,加热到质量不再改变为止,剩余固体质量为27.6g,下列说法正确的是( )
①原子的种类、元素的种类、分子的种类均不变
②原子的数目、分子的数目均不变
③原子的质量、元素的质量、物质的总质量均不变
④原子的种类、数量、质量均不变
【实验1】取该混合液50 g,向其中逐滴加入稀盐酸,当加入稀盐酸的质量分别为20 g、40 g、60 g时,生成气体的质量见下表(气体的溶解忽略不计)。
| 第一组 | 第二组 | 第三组 | |
| 稀盐酸的质量/g | 20 | 40 | 60 |
| 生成气体的质量/g | 2.2 | m | 5.5 |
【实验2】另取该溶液50 g,加入一定量稀盐酸充分反应后,测得溶液的pH=7,然后再加入硝酸银溶液,测得有关数据见图。
试分析计算:
-
(1) 【实验1】中,第二组数据m为g。
-
(2) 混合液中碳酸钠的质量分数是多少?
-
(3) 混合液中氯化钠的质量分数是多少?(计算结果精确至0.1%)

-
(1) X是空气中含量最多的气体,其分子式为。
-
(2) 实验室用大理石和稀盐酸制取二氧化碳的化学方程式为。
-
(3) ①天然气的主要成分是CH4 , 点燃CH4之前应。8g CH4完全燃烧消耗32g O2 , 生成a g CO2和18g H2O,则a=。
②由CH4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随有变化(选填“能量”或“原子个数”)。
-
(4) 尿素属于(选填“氮肥”“磷肥”或“钾肥”);写出NH3合成尿素的化学反应方程式:。
 B . 一定量的氢氧化钠溶液中,滴加100克质量分数相同的稀硫酸通入二氧化碳,至恰好完全反应
B . 一定量的氢氧化钠溶液中,滴加100克质量分数相同的稀硫酸通入二氧化碳,至恰好完全反应  C . 一定量的稀盐酸中,滴加硝酸银溶液至过量
C . 一定量的稀盐酸中,滴加硝酸银溶液至过量  D . 一瓶浓盐酸和一瓶浓硫酸,在实验室中敞口放置一定时间
D . 一瓶浓盐酸和一瓶浓硫酸,在实验室中敞口放置一定时间 
| 物质 | X | O2 | CO2 | H2O |
| 反应前质量/g | 16 | 70 | 1 | 0 |
| 反应后质量/g | 0 | 待测 | 45 | 36 |





