含杂质物质的化学反应的有关计算 知识点题库
-
(1) 求所用稀硫酸的溶质质量分数?
-
(2) 除了可求出稀硫酸的溶质质量分数外,你还能求出的化学量有 (填序号,错选不得分)。
①锌的质量 ②铜的质量分数 ③锌的质量分数 ④硫酸锌的质量 ⑤硫酸溶液的体积 ⑥反应后溶液溶质质量分数
某化学兴趣小组用化学方法测定一种钢样品中铁的含量。同学们称取了5.7g钢样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量也为10.0g)中。在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如下表:
-
(1) 反应中产生氢气 克。
-
(2) 这种钢样品中铁的含量是多少?(精确到0.1%)
-
(3) 钢的类型分为:含碳质量(C%)0.03%~0.3%为低碳钢;0.3%~0.6%为中碳钢;0.6%~2%为高碳钢。假设残留在烧杯中的黑色固体全部是炭,则这种钢属于 。
| 试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
| 所取样品的质量/g | 50.0 | 50.0 | 50.0 | 50.0[ |
| 加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
| 生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
请回答下列问题并计算:
-
(1) 经分析,在第1次实验结束后,反应物 完全反应完了。
-
(2) 50.0g样品与足量稀硫酸反应最多能生成气体 g。
-
(3)
计算样品中锌的质量分数(写出具体计算过程)。

-
(4) 请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。
钢铁是重要的金属材料,人类每年要从自然界获取大量的铁矿资源.

-
(1) 目前世界上已有50%以上的废钢铁得到回收利用,其目的是 .
A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈
-
(2) 工业上高炉炼铁得到的主要产品是 ;(填序号) A.纯铁 B.生铁 C.钢
-
(3) 一位同学准备在实验室用下图所示装置模拟工业炼铁.请你据此回答下列问题:
①实验中硬质玻璃管里的现象是:;硬质玻璃管里发生反应的方程式为 .
②装置图中澄清石灰水的作用是 .
③某同学实验完成后,发现过量的澄清石灰水增重0.44g,则该同学通人装置的CO气体质量(填“大于”、“小于”或“等于”)0.28g,原因是 .
-
(4) 某钢铁厂每天消耗5000t含氧化铁84%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?
火力发电厂用燃煤进行发电,由于煤中含有硫元素,燃烧时会产生二氧化硫,所以该发电厂采用石灰石浆吸收废气中的二氧化硫以防止污染大气,其发生反应的化学方程式为2CaCO3+2SO2+O2![]() 2CaSO4+2CO2 , 若处理2000t这种废气(假设废气中的二氧化硫全部被吸收),理论上需要62.6t含碳酸钙80%的石灰石.
2CaSO4+2CO2 , 若处理2000t这种废气(假设废气中的二氧化硫全部被吸收),理论上需要62.6t含碳酸钙80%的石灰石.
试解答:
-
(1) 若二氧化硫排放到空气中,会造成的环境污染问题是.
-
(2) 所吸收的废气中二氧化硫的质量分数是多少?
-
(1) Fe2O3中Fe与O元素的质量比;
-
(2) 这些矿石最多可以炼出含铁98%的生铁 t.

-
(1) 从图中可以看出,12.5g水垢与足量盐酸反应后生成的CO2最多是 g.
-
(2) 水垢中碳酸钙的质量分数是多少?
-
(1) 在一百余种元素中,金属元素的种类比非金属元素的种类,现代社会以各种金属为支撑,其中用量最大、应用最广泛的金属是;
-
(2) 我国早在春秋战国时期就开始炼铁、应用金属铁,现有200t含Fe2O380%的赤铁矿做原料,能生产含杂质4%的生铁;(结果保留至0.1).
-
(3) 在硫酸铜、硫酸锌和稀硫酸的混合溶液中,加入一定量的铁粉,充分反应后,铁粉有剩余,过滤,则滤液中一定没有的溶质是,滤纸上一定含有的物质是.
-
(1) 用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?方程式为:3CO+Fe2O3
 2Fe+3CO2 . (结果精确到0.1)
2Fe+3CO2 . (结果精确到0.1)
-
(2) 某化学小组在实验室用CO和Fe2O3在密闭容器中隔绝空气加强热模拟炼铁过程,一段时间后收集到如表数据:
物质
CO
Fe2O3
Fe
M
CO2
反应前质量(g)
2.8
16
0
0
0
反应后质量(g)
0
0
0
a
b
①预期看到的实验现象应该是;
②实验过程中看到的实验现象与预期的现象相符.但查阅资料可知:CO还原Fe2O3时在一定条件下可生成铁的其它氧化物FeO和Fe3O4 , 二者也均为黑色固体,发生的化学反应方程式分别为Fe2O3+CO
 2FeO+CO2、.
2FeO+CO2、.③表中b的值为;物质M的化学式为.
-
(1) 该3000t生铁中含纯铁t
-
(2) 该炼铁厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?t(计算结果保留整数)

-
(1) 实验中发生反应的化学方程式为;
-
(2) 根据已知条件,列出求解参加反应的氯化镁的质量(x)的比例式为;
-
(3) 样品中氯化镁的含量(质量分数)为;
-
(4) a的数值为;
-
(5) 所得到的溶液M的溶质的质量分数为;
-
(6) 工业上欲制取80t纯度为75%的单质镁,需要用到题中的样品的质量为 (假设样品中的镁元素全部转化为单质镁)。
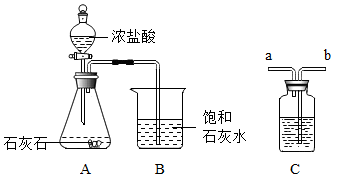
查阅资料:Na2CO3与CO2、H2O反应生成可溶于水的NaHCO3;NaHCO3与HCl反应,与CO2不反应。
①写出装置A中的一种仪器名称。
②反应中装置B内没有变浑浊,用化学方程式解释原因。
③为证明CO2确实能与石灰水反应,在A、B装置之间增加C装置,装置的连接顺序是A→B(填“a”b”);其中盛放的试剂合理的是(填选项序号)。
Ⅰ.浓硫酸;Ⅱ.NaOH溶液;Ⅲ.饱和Na2CO3溶液;Ⅳ.饱和NaHCO3溶液
④改进实验装置后,装置B中饱和石灰水变浑浊了,写出装置B中发生的化学方程式。
⑤石灰石与稀盐酸反应(杂质不与稀盐酸反应),固体质量减少12.5g,则生成二氧化碳气体mol(通过化学方程式计算)。

-
(1) 实验时若先给氧化铁加热,再通一氧化碳可能产生的后果是;
-
(2) 应对尾气处理的主要原因是;
-
(3) 小明同学认为尾气可先储存在瓶内,然后再处理,如图3是他设计的贮气瓶。

①a、b两管应如何伸入,请将图补充完整;
②尾气应从(填“a”或“b”)端管口通入(其他装置略)。
-
(4) 小刚同学提出质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入Fe2O3之前,应先通入澄清石灰水,以排除CO与澄清石灰水的反应,试对此作出评价。你认为小刚同学的设计是否有必要:,理由是。
-
(5) 工业炼铁中焦炭的作用是。
-
(6) 现将50吨含氧化铁80%的铁矿石与足量一氧化碳充分反应后,理论上可得到铁的质量多少。
请完成下列分析及计算:
-
(1) 硫酸(H2SO4)中硫元素的质量分数为(计算结果精确到0.1%)。
-
(2) 反应中共生成气体g。
-
(3) 计算样品中铜的质量分数。
|
次数 |
1 |
2 |
3 |
4 |
5 |
|
加入稀硫酸的质量/g |
24.5 |
24.5 |
24.5 |
24.5 |
24.5 |
|
剩余固体的质量/g |
7.9 |
5.8 |
3.7 |
a |
0.2 |
请计算:
-
(1) H2SO4中硫、氧元素的质量比为(填最简整数比)。
-
(2) 表格中a的值为。
-
(3) 该钢样品中铁的质量分数为。
-
(4) 所加稀硫酸的溶质质量分数。
 2Fe+3CO2。
2Fe+3CO2。
-
(1) 上述反应不是置换反应的理由是:。
-
(2) 根据化学式计算:Fe2O3中铁元素的质量分数。
-
(3) 根据化学方程式计算:用含Fe2O360%的赤铁矿石800t,理论上可炼出纯铁多少吨?
-
(1) 铝具有很好的抗腐蚀性能,原因是;
-
(2) 一氧化碳的还原性可用于冶金工业,写出一氧化碳和氧化铜反应的化学方程式;
-
(3) 向硝酸银溶液中加入一定质量的锌粉和铜粉的混合物,充分反应后过滤,得到滤渣和滤液。以下推断正确的是;
A 若向滤渣中加入稀盐酸有气泡产生,则滤渣中一定有银、铜、锌
B 若滤液为无色,则滤渣中一定有锌
C 若滤液为蓝色,则滤液中一定有硝酸银、硝酸铜和硝酸锌
D 滤渣的质量一定比反应前锌粉和铜粉混合物质量大
-
(4) 下列保护金属资源的做法错误的是(填字母序号)。
A 任意开采矿物
B 回收利用废旧金属
C 铁制品存放在潮湿的环境中
D 用塑料代替金属材料制造管道
-
(5) 在高温下,利用焦炭和氧气反应生成的一氧化碳可把铁从铁矿石里还原出来。某炼铁厂现用1000t含氧化铁70%赤铁矿石,理论上可以炼出含铁96%的生铁的质量是t(计算结果精确到0.1)。



