卤族与氮族及其应用 知识点题库
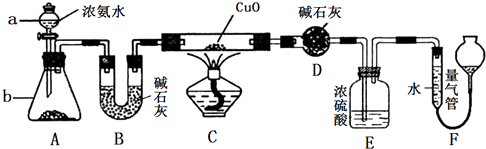
-
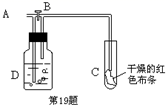
(1) 仪器a的名称为;仪器b中可选择的试剂为;
-
(2) 实验室中利用下列各组物质,进行喷泉实验,不能成功的是A . Cl2与饱和食盐水 B . CO2 与40%的NaOH溶液 C . NH3与饱和食盐水 D . HCl与水
-
(3) 实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有性,写出相应的化学方程式
-
(4) E装置中浓硫酸的作用
-
(5) 实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含m、n字母的代数式表示)

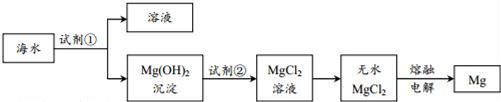
下列说法错误的是( )
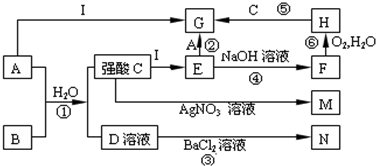
-
(1) 写出①的化学方程式。
-
(2) 写反应②的离子方程式。
-
(3) 写出将A通入石灰乳的化学方程式。
-
(4) 在①→⑥中,属于氧化还原反应的有(填编号)
-
(5) 将NaOH溶液加入到E中的现象为。
-
(6) 写出反应⑥的化学反应方程式。
-
(7) 写出分别将A、B通入石蕊试液中的现象:
AB。
| A对安全的认识 | B用“化学”眼光分析 |
| ①点燃可燃性气体前一定要验纯 ②煤气泄漏立即打开排气扇 ③煤矿矿井要保持通风、严禁烟火 | ①洗涤剂去除油污是因为乳化作用 ②用适量的熟石灰可中和土壤的酸性 ③地里庄稼出现叶色发黄应施用氮肥 |
| C化学与健康 | D对除杂和鉴别的认识 |
| ①霉变的大米洗净烧熟后可以食用 ②利用甲醛水溶液浸泡水产品防腐 ③人体缺铁会导致贫血 | ①用灼热的CuO除去CO中少量CO2 ②用Ca(OH)2溶液除去NaOH溶液中的Na2CO3 ③用燃烧的方法区分羊毛和涤纶 |
| 气体 | a | b | c | |
| A | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
| B | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| C | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| D | CO2 | 稀硫酸 | Na2CO3固体 | 浓硫酸 |
| 选项 | 目的 | 操作 |
| A | 除去Cu粉中混有的CuO | 加入稀硝酸,过滤、洗涤、干燥 |
| B | 探究温度对Fe3+水解程度的影响 | 向25 mL冷水和沸水中分别滴入5滴饱和FeCl3溶液,比较溶液颜色 |
| C | 证明甲苯中的甲基能够活化苯环 | 分别取甲苯和苯与酸性KMnO4溶液反应,观察酸性KMnO4溶液的褪色情况 |
| D | 证明非金属性:Cl>S | 向Na2S溶液中滴加新制氯水,观察实验现象 |
①氨水和液氨不同,氨水是由多种粒子组成的,液氨的组成中只有氨分子
②水泥、玻璃、水晶饰物都是硅酸盐制品
③向铜与浓硫酸反应后的溶液中加水稀释,溶液变蓝,则证明产物有Cu2+生成
④SiO2是酸性氧化物,它不能与任何酸发生反应
⑤铵盐受热分解一定都会产生氨气
⑥可用湿润的淀粉-KI试纸鉴别红棕色的Br2蒸气和NO2气体
| 选项 | 物质 | 主要用途 | 原因解释 |
| A | 晶体硅 | 高纯硅可用于制备光导纤维、光电池、集成电路和计算机芯片 | 硅是良好的半导体材料 |
| B | 金属铝 | 高铁车厢采用铝合金材料 | 铝与氧气不反应 |
| C | 氯气 | 与石灰乳或烧碱反应制备消毒剂 | 氯气有强氧化性 |
| D | 金属钠 | 高温时能从熔融TiCl4中置换出金属Ti | 钠具有很强的还原性 |
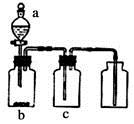
 ,其中a为一个可持续鼓入空气的橡皮球。
,其中a为一个可持续鼓入空气的橡皮球。 
请回答下列问题:
-
(1) 写出装置B中发生反应的化学方程式 。
-
(2) 已知 1mol
 与液态水反应生成
与液态水反应生成  溶液和NO气体放出热量46kJ写出该反应的热化学方程式;该反应是一个可逆反应,欲要提高
溶液和NO气体放出热量46kJ写出该反应的热化学方程式;该反应是一个可逆反应,欲要提高  的转化率,可采取的措施是 (填序号)。
的转化率,可采取的措施是 (填序号)。 A.升高温度 B.降低温度 C.增大压强 D.减小压强
-
(3) 装置C中浓硫酸的作用是。
-
(4) 实验结束后,关闭止水夹b、c,将装置D浸入冰水中,现象是。
-
(5) 实验室制取
 也可以用浓氨水与生石灰反应,反应的化学方程式为。
也可以用浓氨水与生石灰反应,反应的化学方程式为。
-
(6) 干燥管中的碱石灰用于干燥
 ,某同学想用无水氯化钙代替碱石灰,并设计如图所示装置(仪器固定装置未画)进行验证。实验步骤如下:
,某同学想用无水氯化钙代替碱石灰,并设计如图所示装置(仪器固定装置未画)进行验证。实验步骤如下: 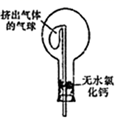
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是,由此该同学得出结论:不能用
 代替碱石灰来干燥氨气。
代替碱石灰来干燥氨气。
| 选项 | 实验操作 | 实验现象或结论 |
| A | 把一小块钠迅速投入到热坩埚中,继续加热坩埚片刻 | 钠受热后熔成小球,剧烈燃烧,火焰呈黄色,产物为淡黄色固体 |
| B | 把小块钠投入到滴有紫色石蕊试液的盛冷水中 | 钠熔化成闪亮的小球,在水面上四处游动,有“嘶嘶”的响声发出,反应后溶液变红 |
| C | 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片 | 鲜花褪色,证明氯气具有漂白性 |
| D | 用洁净铂丝蘸取溶液,在酒精喷灯外焰上灼烧,观察到火焰呈黄色 | 溶液中一定存在 Na+ ,不存在 K+ |

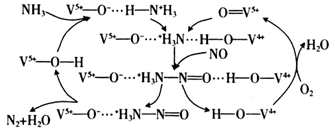
下列说法错误的是( )
 +
+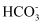 B . CO2负载量为0.2,则溶液中c(
B . CO2负载量为0.2,则溶液中c( )+c(NH3)=5c(
)+c(NH3)=5c( )+5c(
)+5c(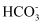 )+5c(H2CO3)
C . 若烟气中混有SO2 , 则CO2的吸附量会下降
D . 提高CO2负载量,CO2的吸附量会降低
)+5c(H2CO3)
C . 若烟气中混有SO2 , 则CO2的吸附量会下降
D . 提高CO2负载量,CO2的吸附量会降低



