氮的氧化物的性质及其对环境的影响 知识点题库
选项 | X | Y | Z | 箭头上为反应条件 |
|
A | NO | NO2 | HNO3 | ②加H2O | |
B | Al | NaAlO2 | AlCl3 | ③电解 | |
C | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
D | NaOH | NaHCO3 | NaCl | ④依次通入CO2、NH3 |
-
(1) 研究发现利用NH3可消除硝酸尾气中的NO污染.NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示:

①用化学反应方程式表示NH3消除NO的反应原理(不用注明反应条件).
②曲线b 对应NH3与NO的物质的量之比是.
③曲线a中,NO的起始浓度为6×10﹣4mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为 mg/(m3•s).
-
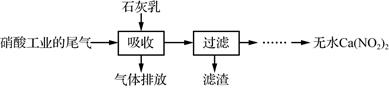
(2) NO、NO2混合气体能被NaOH溶液吸收生成NaNO2和NaNO3 , 若吸收的溶液中NO2﹣的浓度为ag•L﹣1 , 要使1m3该溶液中的NO2﹣完全转化为NH4NO3 , 至少需通入标准状况下的O2L.(用含a的代数式表示,计算结果保留整数)
-
(3) SO2被少许NaOH溶液吸收生成能使pH试纸变红的NaHSO3溶液,工业上可电解NaHSO3得到重要化工产品Na2S2O4 .
①NaHSO3溶液中离子浓度大小为.
②写出生成S2O42﹣的电极反应式.
Ⅰ.采样

采样步骤:
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
-
(1) A中装有无碱玻璃棉,其作用是。
-
(2) C中填充的干燥剂是(填序号)。
a.碱石灰
b.无水CuSO4
c.P2O5
-
(3) 用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。

-
(4) 采样步骤②加热烟道气的目的是。
-
(5) Ⅱ.NOx含量的测定
将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3− , 加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+ , 终点时消耗v2 mL。
NO被H2O2氧化为NO3−的离子方程式是。
-
(6) 滴定操作使用的玻璃仪器主要有。
-
(7) 滴定过程中发生下列反应:
3Fe2++NO3−+4H+=NO↑+3Fe3++2H2O
Cr2O72−+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为mg·m−3。
-
(8) 判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)
若缺少采样步骤③,会使测试结果。
若FeSO4标准溶液部分变质,会使测定结果。
-
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
-
(2) 在含Cu+离子的酶的活化中,亚硝酸根 (NO2-)离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式。
-
(3) 将38.4 g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
① NO2的体积为L。
②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为mol•L-1。
-
(1) 工业上用氢气和氮气直接合成氨,写出反应的化学方程式。氨气极易溶于水,水溶液显 性,能使酚酞溶液变色,使湿润的红色石蕊试纸变色。
-
(2) 氮的氧化物有多种,一氧化氮和二氧化氮都是大气污染物。氨气在催化剂作用下可被氧化生成一氧化氮,一氧化氮气体与空气变色,原因是(用化学方程式表示);二氧化氮易溶于水并与水反应,此反应的氧化剂是,还原剂是,氧化剂和还原剂的质量之比为
-
(1) NOx能形成酸雨,NO2转化为HNO3的化学方程式是。
-
(2) 汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) ∆H=+180kJ·mol-1 , 其能量变化示意图如下:

则NO中氮氧键的键能是 kJ·mol-1。
-
(3) 用NH3可消除NO污染,反应原理为:4NH3+6NO
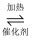 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示: 
①曲线a对应的n(NH3):n(NO)=。
②曲线c中NO的起始浓度为4×10-4mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为 mg/(m3·s)。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是(至少写两条)。

 和NH3·H2O)的一种设计流程如下。下列相关叙述错误的是( )
和NH3·H2O)的一种设计流程如下。下列相关叙述错误的是( ) 
 转化为NH3·H2O
C . 过程Ⅱ中NH
转化为NH3·H2O
C . 过程Ⅱ中NH  →NO
→NO  ,每转化1molNH
,每转化1molNH  转移8NA个电子
D . 过程Ⅲ中甲醇作还原剂,将硝酸还原为N2
转移8NA个电子
D . 过程Ⅲ中甲醇作还原剂,将硝酸还原为N2
下列说法错误的是( )

 B . 铝粉和NaOH溶液反应制取少量H2:
B . 铝粉和NaOH溶液反应制取少量H2: C . NO2通入水中制硝酸:
C . NO2通入水中制硝酸: D . 电解饱和食盐水:
D . 电解饱和食盐水:




