硫酸根离子的检验 知识点题库
下列能够确定溶液中一定含有SO42﹣的事实是( )
A . 取少量试液,加入用盐酸酸化的氯化钡溶液,有白色沉淀生成
B . 取少量试液,加入氯化钡溶液,有白色沉淀生成,再加稀硝酸沉淀不消失
C . 取少量试液,加入硝酸钡溶液,有白色沉淀生成
D . 取少量试液,加入盐酸无现象,再加氯化钡溶液,有白色沉淀生成
下列有关叙述中正确的是( )
A . 19%的MgCl2 溶液中,Cl﹣与H2O个数比为4:45
B . 为检验酸性溶液中Cl﹣和 SO42﹣ , 先加硝酸银溶液,滤去沉淀后滤液中加硝酸钡溶液
C . S8和NO2都是共价化合物,NH4Cl 和CaC2都是离子化合物
D . 若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数可能为m+10
下列有关实验的叙述,正确的是( )
A . 将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液
B . 某溶液与BaCl2溶液反应生成白色沉淀,说明原溶液中有SO42﹣
C . 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D . 可以用湿润的红色石蕊试纸检验是否有氨气生成
化学实验室中常将溶液或试剂进行酸化,下列酸化处理正确的是( )
A . 检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化后,再检验
B . 鉴别溶液中是否有SO42﹣ , 用盐酸酸化
C . 为抑制Fe2+的水解,用稀硝酸酸化
D . 为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化
下列四种溶液中一定存在SO42﹣的是( )
A . 向甲溶液中加入BaCl2溶液,产生白色沉淀
B . 向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,沉淀不溶解
C . 向丙溶液中加入盐酸使之酸化无现象,再加入BaCl2溶液,有白色沉淀
D . 向丁溶液中加入硝酸使之酸化,再加入硝酸钡溶液,有白色沉淀
下列实验操作中有错误的是( )
A . 萃取分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B . 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
C . 蒸馏中,冷却水应从冷凝管的下口通入,上口流出
D . 鉴别SO42﹣时的操作顺序是先加入BaCl2溶液,再加稀盐酸
向四支试管中分别加入少量不同的无色溶液进行如下操作,现象、结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 加入浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| B | 加入苯,振荡、静置 | 分层,下层溶液显橙红色 | 原溶液中一定有溴单质 |
| C | 滴加氯化钡溶液,再加盐酸 | 白色沉淀产生 | 一定有SO42- |
| D | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液一定含钠盐 |
A . A
B . B
C . C
D . D
检验某溶液中是否含有SO42-时,为防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )
A . 先加稀HCl将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀;
B . 先加稀HNO3将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀;
C . 向溶液中滴加稀盐酸酸化的BaCl2溶液,看是否生成白色沉淀;
D . 向溶液中滴加稀硝酸酸化的BaCl2溶液,看是否生成白色沉淀;
下列关于离子检验叙述正确的是( )
A . 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,说明原溶液中有 Na+ , 一定无 K+
B . 某溶液与浓 NaOH 溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在 NH4+
C . 某溶液中加入 BaCl2 溶液,产生白色沉淀,说明原溶液中一定存在 SO42-
D . 某溶液中加入 AgNO3 溶液,产生白色沉淀,说明原溶液中一定存在 Cl-
用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是( )
A . 形成较多的白色沉淀
B . 形成的沉淀纯度更高
C . 排除CO32-等阴离子及Ag+的干扰
D . 排除Ba2+以外的其它阳离子的干扰
下列操作能达到实验目的或不影响实验的是( )
A . 容量瓶用水洗净后,可不经干燥直接用于配制溶液
B . 向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
C . 向溶液中滴加盐酸酸化的氯化钡,若有白色沉淀,说明溶液中含硫酸根
D . 蒸馏时应先加热然后再通冷凝水
下列实验中,对应的现象及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液一定为钠盐溶液 |
| B | 用浓盐酸和石灰石反应产生的气体直接通入Na2SiO3溶液中 | Na2SiO3溶液变浑浊 | C元素的非金属性大于Si元素 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 向某溶液中加入稀硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中一定存在SO42- |
A . A
B . B
C . C
D . D
某溶液可能含有 K+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验:(所加试剂均过量,气体全部逸出)下列说法错误的是( )

A . 原溶液中一定存在SO42–、CO32–和NH4+
B . 原溶液中一定不存在Ca2+ , 无法判断Cl–是否存在
C . 要确定Cl–是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D . 原溶液中 c(K+ )≥0.1 mol· Lˉ 1
“皮鞋很忙”的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
-
(1) 已知
 中铬元素是+3价,则其中铁元素是价。
中铬元素是+3价,则其中铁元素是价。  是一种酸根离子,则
是一种酸根离子,则  属于(填“酸”“碱”“盐”或“氧化物”)。
属于(填“酸”“碱”“盐”或“氧化物”)。
-
(2) 明胶的水溶液和
 溶液共同具备的性质是(填序号)。
溶液共同具备的性质是(填序号)。 a.都不稳定,密封放置沉淀
b.能产生丁达尔效应
c.分散质粒子可通过滤纸
-
(3) 现有10mL明胶的水溶液与5mL
 溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明  能够透过半透膜:。
能够透过半透膜:。
为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
-
(1) I.甲方案
实验原理:
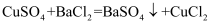
实验步骤:

判断
 沉淀完全的操作为。
沉淀完全的操作为。 -
(2) 步骤②判断沉淀是否洗净所选用的试剂为。
-
(3) 步骤③灼烧时盛装样品的仪器名称为。
-
(4) 若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)(填“偏高”、“偏低”或“无影响”)。
-
(5) II.乙方案
实验原理:
 、
、 
实验步骤:
①按如图安装装置(夹持仪器略去)

②……
③在仪器A、B、C、D、E中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
步骤②为。
-
(6) 步骤⑥需保证体系恢复到室温的原因是(填序号)。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
-
(7) Zn粉质量为a g,若测得H2体积为b mL,已知实验条件下
 ,则c(CuSO4)mol·L−1(列出计算表达式)。
,则c(CuSO4)mol·L−1(列出计算表达式)。
-
(8) 若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)(填“偏高”、“偏低”或“无影响”)。
下列检验某未知溶液中是否含有  的操作最合理的是( )
的操作最合理的是( )
 的操作最合理的是( )
的操作最合理的是( )
A . 加入硝酸酸化的硝酸钡溶液
B . 加入盐酸酸化的氯化钡溶液
C . 先加硝酸酸化,再加硝酸钡溶液
D . 先加入盐酸酸化,再加氯化钡溶液
只用一种试剂,将NH4Cl、(NH4)2SO4、NaCl、Na2SO4等4种物质的溶液区分开(必要时可加热),这种试剂是( )
A . Ba(OH)2溶液
B . BaCl2溶液
C . NaOH溶液
D . AgNO3溶液
下列对某溶液所含离子的检验,叙述正确的是( )
A . 滴BaCl2溶液和稀硝酸,产生白色沉淀,则原溶液中一定含有SO42-
B . 滴人盐酸酸化,再滴入硝酸银溶液,产生白色沉淀,则原溶液中一定含有Cl-
C . 滴入NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定含有NH4+
D . 滴入KSCN溶液无明显现象,再通入少量Cl2后呈红色,则原溶液中一定含有Fe2+
高纯砷(As)常用于制造砷化镓、砷化锗等半导体材料。工业上用含砷废料(主要成分为  ,含少量
,含少量  )为原料制取高纯砷的工艺流程(硫化—还原法)如下图所示:
)为原料制取高纯砷的工艺流程(硫化—还原法)如下图所示:
 ,含少量
,含少量  )为原料制取高纯砷的工艺流程(硫化—还原法)如下图所示:
)为原料制取高纯砷的工艺流程(硫化—还原法)如下图所示: 
已知:砷酸(H3AsO4)在酸性条件下有强氧化性,能被  、氢碘酸等还原为亚砷酸(H3AsO3),H3AsO3在加热蒸发过程中会失水生成
、氢碘酸等还原为亚砷酸(H3AsO3),H3AsO3在加热蒸发过程中会失水生成  。
。 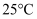 时
时  的值为
的值为 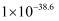 。
。
回答下列问题:
-
(1) 半导体材料
 中
中 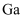 元素的化合价为,“氧化(加压)”时
元素的化合价为,“氧化(加压)”时  发生反应的化学方程式为。
发生反应的化学方程式为。
-
(2) 用
 溶液调溶液的
溶液调溶液的  时,
时,  的最小值为 (当溶液中某离子浓度为
的最小值为 (当溶液中某离子浓度为  时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
-
(3) “还原”过程发生反应的离子方程式为。
-
(4) 过程中,检验
 还原砷酸后所得溶液中是否仍存在砷酸。需进行的实验操作是:取
还原砷酸后所得溶液中是否仍存在砷酸。需进行的实验操作是:取  还原砷酸后的溶液于试管中,(请补充完整)。
还原砷酸后的溶液于试管中,(请补充完整)。
-
(5) 工业上用硫化-还原法制取砷的优点是。
下列有关离子的检验方法正确的是( )
A . 向某溶液中加入稀硫酸酸化后,再加入铜片,微热,有无色气体放出,在试管口处气体变为红棕色,可证明原溶液中含有  B . 向某溶液中先加入
B . 向某溶液中先加入 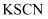 溶液,无现象,再通入
溶液,无现象,再通入  ,溶液变为红色,可证明原溶液中含有
,溶液变为红色,可证明原溶液中含有  ,不含
,不含  C . 向某溶液中加入
C . 向某溶液中加入  溶液,有白色沉淀生成,再加稀盐酸,沉淀不溶解,可证明原溶液中含有
溶液,有白色沉淀生成,再加稀盐酸,沉淀不溶解,可证明原溶液中含有  D . 向某溶液中加入浓盐酸,加热有气体产生,将气体通入品红溶液,品红褪色,可判断原溶液中含有
D . 向某溶液中加入浓盐酸,加热有气体产生,将气体通入品红溶液,品红褪色,可判断原溶液中含有 
 B . 向某溶液中先加入
B . 向某溶液中先加入 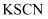 溶液,无现象,再通入
溶液,无现象,再通入  ,溶液变为红色,可证明原溶液中含有
,溶液变为红色,可证明原溶液中含有  ,不含
,不含  C . 向某溶液中加入
C . 向某溶液中加入  溶液,有白色沉淀生成,再加稀盐酸,沉淀不溶解,可证明原溶液中含有
溶液,有白色沉淀生成,再加稀盐酸,沉淀不溶解,可证明原溶液中含有  D . 向某溶液中加入浓盐酸,加热有气体产生,将气体通入品红溶液,品红褪色,可判断原溶液中含有
D . 向某溶液中加入浓盐酸,加热有气体产生,将气体通入品红溶液,品红褪色,可判断原溶液中含有 
最近更新



