元素周期律 知识点题库
已知A、B、C、D、E、F都是短周期的主族元素,原子序数依次增大,其中A是宇宙中最丰富的元素,B的单质常温下为气体,C和E同主族,C和E可形成EC2和EC3两种分子,D是短周期中原子半径最大的元素.请回答下列问题:
-
(1) ①B在元素周期表中的位置;
②上述元素的最高价氧化物的水化物中酸性最强的是(写化学式).
-
(2) C,D,E,F四种元素对应的简单离子的半径由小到大的顺序是(用离子符号表示).
-
(3) A和C可形成两种液态化合物X和Y,用电子武表示原子个数之比为1:1的物质Y的形成过程;在微电子工业中,氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为.
已知X,Y,Z,W为短周期的主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
X | Y |
Z | W |
A . 若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B . 若四种元素均为非金属,则W的最高价氧化物对应水化物一定为强酸
C . 若四种元素中只有一种为金属,则Y的最高价氧化物对应水化物一定为强酸
D . 若四种元素均为金属,则Z的最高价氧化物对应水化物一定为强碱
短周期元素的性质递变规律如图所示,下列说法正确的是( )
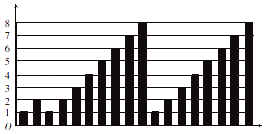
A . 横坐标为质子数,纵坐标为元素的最高正价
B . 横坐标为原子序数,纵坐标为元素原子的最外层电子数
C . 横坐标为核电荷数,纵坐标为元素原子的半径
D . 横坐标为中子数,纵坐标为元素的非金属性
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D 的阳离子的电子排布式均为ls22s22p6 , A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:
-
(1) C元素原子的第一电离能(填“>”、“<”、“=”)D,理由是.
-
(2) 上述六种元素按电负性从小到大的排列是.(填元素符号)
-
(3) C、D、E、F元素形成的最高价氧化物中(填化学式)是离子化合物,(填化学式)是共价化合物.
-
(4) 上述元素的最高价氧化物对应水化物的酸性由强到弱的排列是:.(填化学式)
下列说法中不正确的是( )
A . 位于周期表中同一周期的元素,原子具有相同的电子层数
B . 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8
C . 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数
D . 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增
下列关于元素周期表的说法正确的是( )
A . 元素周期表短周期中有6种金属元素
B . 元素周期表中第ⅦA族有4种非金属元素
C . 元素周期表中第1、2、3周期为短周期
D . 元素周期表中第ⅠA族全部是金属元素
一种高容量的固态锂电池以锂超离子固态导体(组成为Li30GeP2S2)为电解质,该锂电池能在-100℃至100℃之间的超宽温度范围内工作,下列说法错误的是( )
A . Li的原子结构示意图为 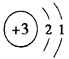 B . 原子半径:P>S
C . 酸性:H3PO4<H2SO4
D . Li、Ge、.P、S都属于短周期元素
B . 原子半径:P>S
C . 酸性:H3PO4<H2SO4
D . Li、Ge、.P、S都属于短周期元素
 B . 原子半径:P>S
C . 酸性:H3PO4<H2SO4
D . Li、Ge、.P、S都属于短周期元素
B . 原子半径:P>S
C . 酸性:H3PO4<H2SO4
D . Li、Ge、.P、S都属于短周期元素
短周期主族元素X、Y、Z、M,X、Y、Z在周期表中的位置关系如图,X和Y能形成两种化合物,M与Y同周期,且M是同周期中原子半径最大的元素。下列说法错误的是( )
Z | X |
Y |
A . X、Y、Z元素的气态氢化物中,Y的氢化物的沸点最高
B . Z和M组成的化合物为离子化合物,它与盐酸反应能生成两种盐
C . 四种元素简单离子的半径由大到小依次为:Y>Z>X>M
D . 含Y元素的所有18电子微粒均可与Cl2发生反应
X、Y、Z、W均为短周期元素且原子序数依次增大,X 是宇宙中含量最多的元素,Y 与W 同主族且可形成WY2 和WY3 型化合物,Z 与Y 形成的化合物是光纤制品的基本原料。下列说法正确的是( )
A . 原子半径:X<Y<Z<W
B . W 的含氧酸一定是强酸
C . Y 与Z 形成晶体的基本结构单元为四面体
D . X 与Y 只能形成一种化合物
根据元素周期表和元素周期律,判断下列叙述错误的是( )
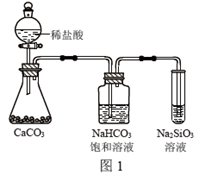
A . 气态氢化物的稳定性:H2O>NH3>SiH4
B . 氢元素与其他元素可形成共价化合物或离子化合物
C . 图1所示实验可证明元素的非金属性:Cl>C>Si
D . 用中文“  ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
W、X、Y、Z均为短周期主族元素,原子序数依次增大。X原子的次外层电子数为a,最外层电子数为b;Y原子的L层电子数为(a+b),M层电子数为(b-a);W、Z原子的最外层电子数分别为(b-1)和b。下列有关说法一定正确的是( )
A . 气态氢化物的稳定性:X<Y
B . 氧化物的水化物的酸性:W<Z
C . 原子半径:W>Z
D . X与Y形成的化合物常温下不能与盐酸反应
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
A . 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B . Y分别与Z、W形成的化合物中化学键类型相同
C . X的最高价氧化物对应水化物的酸性比W的弱
D . Y的气态简单氢化物的热稳定性比W的强
X、Y、Z、Q、W五种短周期元素,核电荷数依次增加。只有Q为金属,X与Q同主族,Z与W同主族,Y原子最外层电子数是内层电子数的2倍,Q+与Z3-具有相同的电子层结构。下列说法正确的是( )
A . Z的氧化物都能跟碱反应
B . Z的氢化物与Z的最高价氧化物的水化物能发生反应
C . Y的最高价氧化物的水化物是非电解质
D . 原子半径Q <W
现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法正确的是( )

A . 原子半径由小到大的顺序是:W<Z<Y<X
B . Z的最高价氧化物对应的水化物一定为强酸
C . 化合物的沸点由高到低的顺序是:乙>甲>丙
D . Y与W、Z都只能形成两种化合物
元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,Z+[Y-W≡X]−是实验室常用的一种化学试剂。下列说法正确的是( )
A . 最简单氢化物沸点高低:W>X
B . 常见单质的氧化性强弱:W>Y
C . 简单离子半径大小顺序:Z>Y
D . 化合物Z2Y的水溶液呈碱性
原子序数1—18号元素中:
-
(1) 与水反应最剧烈的金属单质是
-
(2) 原子半径最小的元素是(元素符号);
-
(3) 气态氢化物中分子间存在氢键的卤素是(元素符号);
-
(4) 最高价氧化物对应水化物的酸性最强的元素是(元素符号)。
下列各组比较中,错误的是( )
A . 半径: 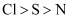 B . 热稳定性:
B . 热稳定性: 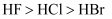 C . 酸性:
C . 酸性:  D . 还原性:
D . 还原性: 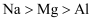
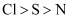 B . 热稳定性:
B . 热稳定性: 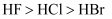 C . 酸性:
C . 酸性:  D . 还原性:
D . 还原性: 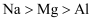
下列关于元素周期表的说法正确的是( )
A . 元素周期表有7个周期,8个主族
B . 元素周期表有18个纵列,共16个族
C . 短周期元素中可能有副族元素
D . 最外层电子数相同的元素一定在同一族
短周期元素W、X、Y和Z在元素周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
W | X | |||
Y | Z |
A . 氢化物沸点:W>X
B . 简单离子的半径:Y<X
C . 化合物熔点:Y2X3<YZ3
D . 氧化物对应水化物的酸性:Y>W
不同主族的短周期元素X、Y、Z、W其原子序数依次增大,X、Y的简单离子的电子层结构相同,短周期主族元素原子中Y的原子半径最大,Z原子最外层电子数是K层的3倍。下列说法错误的是( )
A . 熔化YW时离子键被破坏
B . X的简单氢化物可作制冷剂
C . 离子的还原性:Z>W
D . Y的氧化物为离子化合物,不含共价键
最近更新



