元素周期律 知识点题库
具有下列电子排布式的原子中,半径最大的是( )
A . 1s22s22p63s23p3
B . 1s22s22p3
C . 1s22s22p2
D . 1s22s22p63s23p2
W,X,Z是原子序数依次增大的同一短周期元素,W,X是金属元素,Z是非金属元素,W,X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )

A . d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B . c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C . b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D . a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
四种短周期元素在周期表中的位置如表,其中只有M元素原子最外层电子数与电子层数相等,下列说法不正确的是( )
Y | Z | ||
M | X |
A . 原子半径Z<M
B . 非金属性:X<Z
C . M元素最高价氧化物对应水化物具有两性
D . Y的最高价氧化物对应水化物的酸性比X的弱
按要求填空
-
(1) X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的一种单质具有特殊臭味,Z与X原子最外层电子数相同.回答下列问题:
(I)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物的电子式;
(II)X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键.此化合物可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为
-
(2) 在一定条件下,RO3nˉ 和Iˉ发生反应,离子方程式为:RO3nˉ+6Iˉ+6H+═Rˉ+3I2+3H2O
RO3n﹣中R元素的化合价为,R元素的原子最外层电子有个.
-
(3) Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4 , 而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
-
(4) 已知M2On2ˉ可与R2ˉ作用,R2ˉ被氧化为R的单质,M2On2ˉ的还原产物中,M为+3价,又知c(M2On2ˉ)=0.3mol/L的溶液100mL可与c(R2ˉ)=0.6mol/L的溶液150mL恰好完全反应,则n值为
对于核电荷数为56的元素,下列描述正确的是( )
A . 其单质在常温下与水反应不如钙剧烈
B . 其碳酸盐难溶于水
C . 其主要化合价为+1价
D . 其氢氧化物不能使Al(OH)3溶解
-
(1) 下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
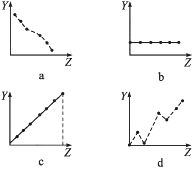
①ⅡA族元素的价电子数。
②第三周期元素的最高化合价。
③F-、Na+、Mg2+、Al3+的离子半径。
-
(2) 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为,B的化学式为。
③工业上制取单质M的化学方程式为。
依据元素周期表及元素周期律,下列推测不正确的是()
A . H2SiO3的酸性比H2CO3的强
B . Mg(OH)2的碱性比Be(OH)2的强
C . HCl的热稳定性比H2S的强
D . Na的金属性比Al的强
在一定条件下,RO3-与R-发生如下反应RO3-+5R-+6H+=3R2+3H2O,下列有关R元素的叙述正确的是( )
A . R是第ⅤA族元素
B . R2在常温下一定是气体
C . RO3-A中的R元素只能被还原
D . R的氢化物的水溶液是强酸
下列说法正确的是( )
A . Li、Be、B原子半径依次增大
B . Cl、Br、I含氧酸的酸性依次减弱
C . Na与Na+化学性质相同
D . 147N与157N得电子能力相同
下列各选项对应关系错误的是( )
A .  表示F-、Na+、Mg2+、Al3+四种半径的大小关系
B .
表示F-、Na+、Mg2+、Al3+四种半径的大小关系
B .  表示ⅡA族元素原子的最外层电子数
C .
表示ⅡA族元素原子的最外层电子数
C .  表示第三周期各主族元素的最高化合价
D .
表示第三周期各主族元素的最高化合价
D .  表示第三周期中各主族元素的最高化合价与最低化合价之和
表示第三周期中各主族元素的最高化合价与最低化合价之和
 表示F-、Na+、Mg2+、Al3+四种半径的大小关系
B .
表示F-、Na+、Mg2+、Al3+四种半径的大小关系
B .  表示ⅡA族元素原子的最外层电子数
C .
表示ⅡA族元素原子的最外层电子数
C .  表示第三周期各主族元素的最高化合价
D .
表示第三周期各主族元素的最高化合价
D .  表示第三周期中各主族元素的最高化合价与最低化合价之和
表示第三周期中各主族元素的最高化合价与最低化合价之和
下列不能说明氯的非金属性比硫强的事实是:( )
①HCl比H2S稳定;②HClO氧化性比H2SO4强;③HClO4酸性比H2SO4强;④Cl2能与H2S反应生成S; ⑤氯原子最外层有7个电子,硫原子最外层有6个电子;⑥Cl2与Fe反应生成FeCl3 , S与Fe反应生成FeS;⑦HCl酸性比H2S 强
A . ②⑤⑦
B . ①②⑦
C . ②④⑥
D . ①③⑤
门捷列夫周期表是常见的经典形式,人们在研究前18号元素时发现,还可以将它们排成如图所示的“海螺”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )

A . A、B元素的简单离子半径比较A﹥B
B . 虚线相连的元素处于同一族
C . B元素是图中金属性最强的元素
D . A、B两种元素组成的化合物中只含有离子键
X、Y、Z、W为原子序数依次增大的短周期元素,X的单质在标准状况下为气体且密度约为1.428 g·L-1 , Y的氢氧化物是一种强碱,Z与Y位于同周期且Z原子的最外层电子数是内层电子数的一半,W与X同一主族。下列说法正确的是( )
A . 原子半径:W>Z>Y>X
B . Y、W不可能形成化合物Y2W2
C . 简单氢化物的稳定性:X>Z>W
D . Y2X2可与WX2发生氧化还原反应
X、Y、Z、R为元素周期表前二十号元素,原子序数依次增大,X、Z和Y、R分别为同主族元素,Z单质为优良半导体,Y 的原子半径在短周期主族元素中最大,W 为R的最高价氧化物对应的水化物。下列叙述正确的是( )
A . Y 的氧化物中一定不含有共价键
B . 单质Z是光导纤维的主要成分
C . X元素在自然界中不存在游离态
D . R的最高价氧化物对应水化物为碱性
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )

A . 氢化物沸点:X<Z
B . 最高价氧化物对应水化物的酸性:Y>W
C . 化合物熔点:  D . 简单离子的半径:Y<X
D . 简单离子的半径:Y<X
 D . 简单离子的半径:Y<X
D . 简单离子的半径:Y<X
随着核电荷数的递增,氧化性逐渐减弱的一组是( )
A . I2、Br2、Cl2、F2
B . F2、Cl2、Br2、I2
C . F-、Cl-、Br-、I-
D . Li、Na、K、Rb
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W在地壳中含量最高;X遇水剧烈反应;Y的单质可用于光伏发电;Z的最外层电子数比次外层电子数少1个。下列说法错误的是( )

A . 简单离子半径:X>W
B . 简单气态氢化物的稳定性:Y<Z
C . 化合物XZW既含离子键,也含共价键
D . Y与Z形成的二元化合物中,各原子均达到8电子稳定结构
元素周期表和元素周期律对其他与化学相关的科学技术有指导作用。下列说法错误的是( )
A . 位于周期表中金属与非金属分界处的金属铝具有氧化性和还原性
B . 制造农药的主要元素是在右上方区域的非金属元素
C . 作催化剂的主要元素分布在过渡元素区域
D . 在周期表中金属与非金属的分界处,可以找到半导体材料
物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为地壳含量最高的金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:
回答下列问题:

-
(1) Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是,写出YX的电子式。
-
(2) 比较X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)。
-
(3) 在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式。
已知W、X、Y、Z均为短周期主族元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH值和原子半径、原子序数的关系如图所示。下列说法正确的是( )

A . 简单离子半径:Z>Y>W>X
B . Z的单质具有强氧化性和漂白性
C . 同浓度简单氢化物水溶液的酸性:Z>Y
D . 化合物X2Y2中含有极性共价键和非极性共价键
最近更新



