元素周期律和元素周期表的综合应用 知识点题库
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:

-
(1) Y元素在周期表中的位置为
-
(2) X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入的物质名称是 负极电极反应式为
-
(3) X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐.该盐水溶液pH 7(填“大于”、“小于”或“等于”),其原因是(用离子方程式表示): 该溶液中所有离子浓度大小顺序为
-
(4) 试写出实验室制取C的化学方程式
-
(1) E元素在周期表中的位置为.写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式.
-
(2) 由A,B,W三种元素组成的18电子微粒的结构简式为.
-
(3) 经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2 , 写出该反应的化学方程式.
-
(4) 向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2 , 观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是.
-
(5) 元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是 L(标准状况下).

-
(1) D元素原子的结构示意图为;
-
(2) A、B、C三种元素的原子半径由小到大的顺序为(用元素符号表示);
-
(3) Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为;
-
(4) A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为(用具体离子符号表示);
-
(5) 实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是(用化学方程式表示).
选项 | 参数 | 比较 | 解释 |
A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
B | 半径 | Na+>Al3+>S2﹣ | 同一周期粒子半径随原子序数的递增逐渐减小 |
C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
D | 还原性 | P3﹣>S2﹣>Cl﹣ | 元素的非金属性越强,简单阴离子的还原性越弱 |
①A,B,C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的元素.
-
(1) A的名称是,B位于周期表中第周期族,C的原子结构示意图是.
-
(2) E的单质颜色是.
-
(3) A元素与D元素形成化合物的电子式是.
-
(4) G的单质与水反应的化学方程式是.
-
(5) F的元素符号是.
-
(6) 在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是,酸性最强的化学式是,气态氢化物最稳定的化学式是.
-
(7) 将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是:.

-
(1) 写出B+乙→甲+C的化学反应方程式。
-
(2) 根据以上条件可以确定A、B、C、D四种元素中的三种,分别是、、(元素符号)
-
(3) 依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙、丁都是无色有刺激性气味的物质。据此,请回答下列问题:
A.写出上述第四种元素在周期表中的位置。
B.写出C+丙→乙+丁的化学反应方程式。

| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要 化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | — |
| 最低负价 | — | -1 | — | — | -3 | -2 | |
有关X、Y、Z、M、R和Q的下列说法正确的是( )


 、
、  和
和  ;Y与氧元素可组成离子化合物
;Y与氧元素可组成离子化合物  和
和  。
。
-
(1) 写出
 的电子式:,其中含有的化学键类型是。
的电子式:,其中含有的化学键类型是。
-
(2) Z元素在元素周期表中的位置是第周期第族。
-
(3)
 、
、  和
和  三种化合物,其中一种与另外两种都能反应,该化合物是(填化学式)。
三种化合物,其中一种与另外两种都能反应,该化合物是(填化学式)。
-
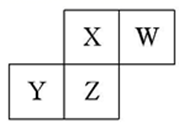
(4) 由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:。
①熔点:F2<Cl2<Br2<I2
②沸点:Li<Na<K<Rb<Cs
③密度:Li<Na<K<Rb<Cs
④稳定性:HCl>H2S>PH3
⑤还原性:F->Cl->Br-
⑥碱性:KOH>Ca(OH)2>Mg(OH)2
 ;D和氢原子可形成4核10电子分子,该分子可使湿润的红色石器试纸变蓝:A、C同周期,B和C同主族;A与B可形成两种离子化合物
;D和氢原子可形成4核10电子分子,该分子可使湿润的红色石器试纸变蓝:A、C同周期,B和C同主族;A与B可形成两种离子化合物  、
、  ,氢原子与B可形成两种共价化合物
,氢原子与B可形成两种共价化合物  、
、  。试回答下列问题:
。试回答下列问题:
-
(1) C元素的元素符号为;写出A的电子排布式。
-
(2) 写出D元素形成的
 分子的结构式,其中
分子的结构式,其中  键与
键与  键的数目比为。
键的数目比为。
-
(3) B、D元素的第一电离能大小关系为:BD(填“<”或“>”)。
-
(4)
 对应的水化物的碱性比
对应的水化物的碱性比  (填“强”或“弱”);写出
(填“强”或“弱”);写出  的电子式。
的电子式。
-
(5) 化合物
 、
、  它们结构与组成相似,热稳定性更强的是(填化学式),
它们结构与组成相似,热稳定性更强的是(填化学式),  的沸点比
的沸点比  高得多的原因是。
高得多的原因是。
-
(6) 下列选项能作为C元素和氧元素非金属性强弱比较的依据的是。
a.C的氧化物对应的水化物的酸性弱于盐酸
b.C元素的电负性小于氯的电负性
c.化学反应:

-
(7) B和C可以形成化合物
 ,
,  分子中空间结构为(填“V型”成“直线型”)。中心原子C采用杂化。
分子中空间结构为(填“V型”成“直线型”)。中心原子C采用杂化。
-
(8) 元素B和铜原子形成的化合物
 晶体结构可能是(填字母)。
晶体结构可能是(填字母)。 
 和
和 , 用湿润的淀粉KI试纸检验
, 用湿润的淀粉KI试纸检验 时生成
时生成 和
和 。下列说法错误的是( )
。下列说法错误的是( )
 在水中能稳定存在
C . X和Z组成的化合物可能是干燥剂
D . 气态氢化物的热稳定性:R>Z
在水中能稳定存在
C . X和Z组成的化合物可能是干燥剂
D . 气态氢化物的热稳定性:R>Z



