燃烧热 知识点题库
下列说法或表示法正确的是( )
A . 由C(石墨)→C(金刚石) △H= +1.9kJ/mol 可知金刚石比石墨稳定
B . 在101KPa时,1mol碳燃烧所放出的热量为碳的燃烧热
C . 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) = 2H2O(l);△H= -571.6kJ/mol
D . HCl和NaOH反应的中和热△H= -57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H= -(2×57.3)kJ/mol
下列各组物质的燃烧热相等的是( )
A . C和CO
B . 红磷和白磷
C . 3molC2H2(乙炔)和1molC6H6(苯)
D . 1gH2和2gH2
按要求填空
-
(1) 已知H2的燃烧热:△H=﹣285.8kJ•mol﹣1 , C的燃烧热:△H=﹣393.5kJ•mol﹣1 , 若要得到1000kJ的热量,需完全燃烧 mol的H2生成液态水;2.5molC在O2中完全燃烧生成CO2 , 放出 kJ的热量,(保留到小数点后1位).
-
(2) 0.05mol某液态有机物2.3g和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g液态水和2.24CO2(标准状况)并放出68.35kJ热量,则能表达该有机物燃烧热的热化学方程式是.
已知:S(s)+O2 (g)=SO2 (g)△H=﹣297KJ/mol,下列说法不正确的是( )
A . S的燃烧热为297KJ/mol
B . 1mol硫蒸气完全燃烧放出的热量大于297KJ
C . 1mol硫蒸气完全燃烧放出的热量小于297KJ
D . 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol﹣1
②CH3OH(g)+  O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJ•mol﹣1
O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJ•mol﹣1
下列说法正确的是( )
A . CH3OH的燃烧热为192.9 kJ•mol﹣1
B . 反应①中的能量变化如图所示 C . CH3OH转变成H2的过程一定要吸收能量
D . 根据②推知反应CH3OH(l)+
C . CH3OH转变成H2的过程一定要吸收能量
D . 根据②推知反应CH3OH(l)+  O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJ•mol﹣1
O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJ•mol﹣1
 C . CH3OH转变成H2的过程一定要吸收能量
D . 根据②推知反应CH3OH(l)+
C . CH3OH转变成H2的过程一定要吸收能量
D . 根据②推知反应CH3OH(l)+  O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJ•mol﹣1
O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJ•mol﹣1
已知在25 ℃、101 kPa下,0.5 mol辛烷C8H8燃烧生成二氧化碳和液态水时放出2 759 kJ热量。表示上述反应的热化学方程式正确的是( )
A . C8H18(l)+ 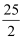 O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B . C8H18(l)+
O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B . C8H18(l)+ 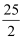 O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C . C8H18(l)+
O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C . C8H18(l)+ 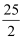 O2(g)=8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D . 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) ΔH=+11 036 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D . 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) ΔH=+11 036 kJ·mol-1
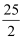 O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B . C8H18(l)+
O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B . C8H18(l)+ 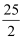 O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C . C8H18(l)+
O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C . C8H18(l)+ 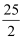 O2(g)=8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D . 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) ΔH=+11 036 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D . 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) ΔH=+11 036 kJ·mol-1
能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
-
(1) 我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是 ___________________(填字母)。A . 煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用 B . 煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠 C . 煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重 D . 通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
-
(2) 乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式为。
-
(3) 由于C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ•mol−1(b>0)的反应中,反应物具有的总能量(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要(填“放出”或“吸收”)能量才能转化为生成物。
-
(4) 关于用水制取二次能源氢气,以下研究方向错误的是________________A . 组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源 B . 设法将太阳光聚焦,产生高温,使水分解产生氢气 C . 寻找高效催化剂,使水分解产生氢气,同时释放能量 D . 寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
-
(5) 已知下列两个热化学方程式:
A、2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ•mol-1
B、C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ•mol-1 , 其中,能表示燃烧热的热化学方程式为(A或B),其燃烧热为。
恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题: 
-
(1) 写出能表示硫的燃烧热的热化学方程式:。
-
(2) ΔH2=kJ·mol-1。
-
(3) 在相同条件下,充入1 mol SO3和0.5 mol的O2 , 则达到平衡时SO3的转化率为;此时该反应(填“放出”或“吸收”)kJ的能量。
在标准状况下,7.84L甲烷完全燃烧后生成二氧化碳和液态水,同时放出311.4kJ的热量,则甲烷燃烧的热化学方程式是( )
A . CH4+2O2→CO2+2H2O+311.4kJ
B . CH4(g)+2O2(g)→CO2(g)+2H2O(l)+311.4kJ
C . CH4(g)+2O2(g)→CO2(g)+2H2O(l)+889.7kJ
D . CH4(g)+2O2(g)→CO2(g)+2H2O(g)+889.7kJ
下列有关热化学方程式的叙述中,错误的是( )
A . 含20.0gNaOH的稀溶液与稀盐酸完全中和放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ×mol-1
B . 根据C(石量,s)=C(金刚石,s) △H>0可知石墨比金刚石稳定
C . 根据2H2(g)+O2(g)=2H2O(l) △H=-483.6kJ×mol-1可知H2的燃烧热为241.8kJ×mol-1
D . 由C(s)+O2(g)=CO2(g) △H1 , C(s)+  O2(g)=CO(g) △H2可知△H1>△H2
O2(g)=CO(g) △H2可知△H1>△H2
 O2(g)=CO(g) △H2可知△H1>△H2
O2(g)=CO(g) △H2可知△H1>△H2
101kPa、25℃时,已知:S(s)+O2(g)=SO2(g) DH=-297.2kJ×mol-1。下列说法中正确的是( )
A . S(s)具有的能量大于SO2(g)具有的能量
B . S(g)+O2(g)=SO2(g)的DH>-297.2kJmol-1
C . S(s)的燃烧热为297.2kJmol-1
D . S(s)和O2(g)所具有的总能量小于SO2(g)所具有的总能量
已知:2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ/mol;Na2O2(s)+CO2(g)=Na2CO3(s)+  O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
 O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
A . CO的燃烧热为283kJ
B . 如图可表示由CO生成CO2的反应过程和能量关系  C . 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H<﹣452kJ/mol
D . CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为1.204×1024
C . 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H<﹣452kJ/mol
D . CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为1.204×1024
 C . 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H<﹣452kJ/mol
D . CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为1.204×1024
C . 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H<﹣452kJ/mol
D . CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为1.204×1024
甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H1=−71kJ·mol-1
②CO(g)+2H2(g)=CH3OH(l) △H2=−90.5kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=−890kJ·mol-1
下列说法正确的是( )
A . 三个反应均为放热反应,故不需要加热就能进行
B . CO(g)+2H2(g)=CH3OH(g) △H<−90.5kJ·mol-1
C . 25℃、101kPa下,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=−764kJ·mol-1
D . 甲醇−空气碱性燃料电池负极反应式为CH3OH+6OH−−6e−=CO2↑+5H2O
已知:①  ;②
;②  ;下列推断正确的是( )
;下列推断正确的是( )
 ;②
;②  ;下列推断正确的是( )
;下列推断正确的是( )
A . 若  的燃烧热为
的燃烧热为  ,则
,则  的燃烧热为
的燃烧热为  B . 反应
B . 反应  的
的  C . 若反应②的反应物总能量低于生成物总能量,则
C . 若反应②的反应物总能量低于生成物总能量,则  D . 若等物质的量的
D . 若等物质的量的  和
和  完全燃烧生成气态产物时前者放热更多,则
完全燃烧生成气态产物时前者放热更多,则 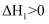
 的燃烧热为
的燃烧热为  ,则
,则  的燃烧热为
的燃烧热为  B . 反应
B . 反应  的
的  C . 若反应②的反应物总能量低于生成物总能量,则
C . 若反应②的反应物总能量低于生成物总能量,则  D . 若等物质的量的
D . 若等物质的量的  和
和  完全燃烧生成气态产物时前者放热更多,则
完全燃烧生成气态产物时前者放热更多,则 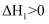
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0kJ·mol-1
②CH3OH(g)+  O2(g)=CO2(g)+2H2(g)ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH=-192.9kJ·mol-1

下列说法正确的是( )
A . CH3OH的燃烧热为192.9kJ∙mol-1
B . 反应①中的能量变化如图所示
C . CH3OH转变成H2的过程一定要吸收能量
D . 根据②推知反应CH3OH(l)+  O2(g)=CO2(g)+2H2(g)的ΔH>-192.9kJ∙mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9kJ∙mol-1
 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9kJ∙mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9kJ∙mol-1
下列说法正确的是( )
A . 氢能是二次能源
B . 可以直接测量任一反应的反应热
C . 碳完全燃烧生成二氧化碳时,放出的热量为碳的燃烧热
D . 测定中和热时,为保证反应充分,可将NaOH溶液分批加入盐酸中
下列说法中正确的是( ΔH 的绝对值均正确)( )
A . 燃烧热指在 101kPa 时,1mol 纯物质完全燃烧生成指定产物时所放出的热量,单位是 kJ/mol。
B . 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,则稀醋酸与稀氢氧化钠溶液反应生成 1mol水的中
和热为-57.3kJ/mol
C . C2H5OH的燃烧热 C2H5OH(l)+3O2(g)=2CO2(g)+3H2 O(g) ΔH=-1367.0kJ/mol D . 需要加热才能发生的反应一定是吸热反应
下列说法正确的是( )
A . 已知2CO2(g)=2CO(g)+O2(g)反应的ΔH=+566.0kJ·mol-1 , 则CO(g)的燃烧热:ΔH=-283.0kJ·mol-1
B . 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ·mol-1 , 则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量
C . 已知2C(s)+2O2(g)=2CO2(g) ΔH=a;2C(s)+O2(g)=2CO(g) ΔH=b,则a>b
D . 已知C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定
下列与化学反应能量变化相关的叙述中,正确的是( )
A . 热化学方程式的ΔH大小与化学计量数无关
B . 利用盖斯定律,可计算某些难以直接测量的反应焓变
C . H2(g)的燃烧热ΔH=-285.8kJ·mol-1 , 则反应2H2O(g)=2H2(g)+O2(g)的反应热ΔH=+571.6kJ·mol-1
D . 测定中和反应反应热的时候,测量盐酸和NaOH混合溶液刚开始的温度,记为反应前体系的温度
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如下:
①

②

下列说法正确的是( )

A . ①中的能量变化如图所示
B . 由②可知 的燃烧热为
的燃烧热为 C .
C .  转变成
转变成 的过程一定是放出能量
D . 根据①推知反应
的过程一定是放出能量
D . 根据①推知反应 的
的
 的燃烧热为
的燃烧热为 C .
C .  转变成
转变成 的过程一定是放出能量
D . 根据①推知反应
的过程一定是放出能量
D . 根据①推知反应 的
的
最近更新



