燃烧热 知识点题库
1.5g 火箭燃料二甲基肼(CH3﹣NH﹣NH﹣CH3)完全燃烧放出50kJ热量,则二甲基肼的燃烧热为( )
A . 2000kJ
B . △H=﹣2000kJ/mol
C . △H=﹣1500kJ/mol
D . ﹣2000kJ/mol
下列热化学方程式中△H的数值表示可燃物燃烧热的是( )
A . CO(g)+ O2(g)═CO2(g)△H=﹣283 kJ•mol﹣1
B . CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802.3 kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ•mol﹣1
D . H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6 kJ•mol﹣1
O2(g)═CO2(g)△H=﹣283 kJ•mol﹣1
B . CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802.3 kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ•mol﹣1
D . H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6 kJ•mol﹣1
 O2(g)═CO2(g)△H=﹣283 kJ•mol﹣1
B . CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802.3 kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ•mol﹣1
D . H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6 kJ•mol﹣1
O2(g)═CO2(g)△H=﹣283 kJ•mol﹣1
B . CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802.3 kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ•mol﹣1
D . H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6 kJ•mol﹣1
已知:①2CO(g)+O2(g)═2CO2(g)△H1=﹣566.0kJ/mol②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ/mol
则1molC(s)在氧气中燃烧生成CO时的△H值为( )
A . +172.5 kJ/mol
B . ﹣172.5 kJ/mol
C . +110.5kJ/mol
D . ﹣110.5kJ/mol
已知:①H2(g)+  O2(g)═H2O(g)△H=﹣241.8kJ/mol
O2(g)═H2O(g)△H=﹣241.8kJ/mol
 O2(g)═H2O(g)△H=﹣241.8kJ/mol
O2(g)═H2O(g)△H=﹣241.8kJ/mol ②  N2 (g)+O2(g)═NO2(g)△H=+33.9kJ/mol
N2 (g)+O2(g)═NO2(g)△H=+33.9kJ/mol
③  N2 (g)+
N2 (g)+ 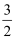 H2(g)═NH3(g)△H=﹣46.0kJ/mol
H2(g)═NH3(g)△H=﹣46.0kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热( )
A . 282.8 kJ/mol
B . ﹣282.8 kJ/mol
C . 848.4kJ/mol
D . ﹣848.4 kJ/mol
对于反应2C4H10(g) + 13O2(g) = 8CO2(g) + 10H2O(l);△H= -5800kJ/mol下列叙述错误的是( )
A . 该反应的反应热为△H= -5800kJ/mol,是放热反应;
B . 该反应的△H与各物质的状态有关,与化学计量数也有关;
C . 该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ;
D . 该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol。
下列说法不正确的是( )
A . 干冰可用于人工降雨
B . 氢气的热值比天然气的低
C . 硫酸铜可用作游泳池消毒
D . 氢氧化铁胶体能用于净水
下列说法或表示方法中正确的是( )
A . 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多
B . 氢气的燃烧热为285.8 kJ·mol-1 , 则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C . Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D . 已知中和反应的反应热ΔH=-57.3 kJ·mol-1 , 若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ
下列说法错误的是( )
A . 化学反应过程中一定伴随着能量的变化,遵循能量守恒定律
B . 氢气热值高,利用化石燃料燃烧放出的热量分解水产生氢气,是氢能开发的方向
C . 101kPa下,S(s)+O2(g)=SO2(g)的反应热可以表示S(s)的标准燃烧热
D . 稀的强酸和强碱反应只生成1molH2O(1)的反应热为中和热
已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220 kJ·mol-1
下列说法正确的是( )
A . H2的燃烧热为571.6 kJ·mol-1
B . C3H8完全燃烧生成1 mol H2O(l)放出的热量为555 kJ
C . 1 mol H2和2 mol C3H8组成的混合气体完全燃烧放出的热量为5011.6 kJ
D . 5 mol H2和C3H8的混合气体,若完全燃烧时放出3847 kJ热量,则V(H2):V(C3H8)=1:3
101 kPa时,下列热化学方程式中的∆H可用来表示燃烧热的是( )
A .  ∆H
B .
∆H
B .  ∆H
C .
∆H
C .  ∆H
D .
∆H
D .  ∆H
∆H
 ∆H
B .
∆H
B .  ∆H
C .
∆H
C .  ∆H
D .
∆H
D .  ∆H
∆H
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫作反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
-
(1) 下列∆H表示物质燃烧热的是;不能表示物质中和热的是。(填字母)
A.H2(g)+
 O2(g)=2H2O(g) ∆H1
O2(g)=2H2O(g) ∆H1B.C(s)+
 O2(g)=CO(g) ∆H2
O2(g)=CO(g) ∆H2C.CH4(g)+2O2g)=CO2(g)+2H2O(l) ∆H3
D.C(s)+O2(g)=CO2(g) ∆H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ∆H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ∆H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ∆H8
-
(2) 2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.8kJ的热量,写出该反应燃烧热的热化学方程式:
-
(3) 充分燃烧一定量的丁烷放出的热量为Q,生成的CO2恰好与100mL浓度为4mol∙L-1的KOH溶液完全反应生成正盐。则燃烧1mol丁烷放出的热量为。
-
(4) 4.4g丙烷完全燃烧生成的CO2与100 mL浓度为4mol∙L-1的KOH溶液恰好完全反应,则反应后的溶液中酸式盐的物质的量是mol
-
(5) 氢能源有可能实现能源的贮存,也有可能实现经济,高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如,LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.65、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附840体积的氢气(钯粉的密度为10.64g∙cm-3 , 相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式。
已知:燃烧热指 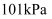 时,
时, 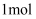 纯物质完全燃烧生成稳定的氧化物时所放出的热量。
纯物质完全燃烧生成稳定的氧化物时所放出的热量。 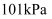 时,下列过程放出的热量属于碳的燃烧热的是( )
时,下列过程放出的热量属于碳的燃烧热的是( )
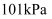 时,
时, 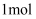 纯物质完全燃烧生成稳定的氧化物时所放出的热量。
纯物质完全燃烧生成稳定的氧化物时所放出的热量。 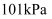 时,下列过程放出的热量属于碳的燃烧热的是( )
时,下列过程放出的热量属于碳的燃烧热的是( )
A .  燃烧完全转化为
燃烧完全转化为  气体
B .
气体
B .  燃烧完全转化为
燃烧完全转化为  气体
C .
气体
C .  燃烧完全转化为
燃烧完全转化为  气体
D .
气体
D .  与
与  反应完全转化为
反应完全转化为  气体
气体
 燃烧完全转化为
燃烧完全转化为  气体
B .
气体
B .  燃烧完全转化为
燃烧完全转化为  气体
C .
气体
C .  燃烧完全转化为
燃烧完全转化为  气体
D .
气体
D .  与
与  反应完全转化为
反应完全转化为  气体
气体
下列说法中正确的是( ΔH的绝对值均正确)( )
A . 热值指在一定条件下单位质量的物质完全燃烧所放出的热量,则CO热值为10.1kJ/g
B . 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,则稀醋酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ/mol
C . C2H5OH的燃烧热C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1367.0kJ/mol
D . N2+2O2=2NO2 ΔH=67.8kJ/mol
下列推论正确的是( )
A . S(g)+O2(g)=SO2(g) ΔH1;S(s)+O2=SO2(g) ΔH2 , 则ΔH1>ΔH2
B . C(石墨,s)=C(金刚石,s) ΔH=+1.9kJ·mol-1 , 则金刚石比石墨稳定
C . OH-(aq)+H+(aq)= H2O(l) ΔH=-57.4kJ·mol-1 , 则:含20gNaOH的稀溶液与过量稀醋酸完全反应,放出的热量为28.7kJ
D . 2C(s)+O2(g)= 2CO(g) ΔH=-221kJ·mol-1 , 则碳的燃烧热大于110.5kJ·mol-1
-
(1) 按系统命名法,
 的名称是:。
的名称是:。
-
(2) 已知丙烯的标准燃烧热为2058 kJ·mol-1 , 请写出丙烯燃烧的热化学方程式。
-
(3) 水的自偶电离方程式为2H2O
 OH−+ H3O + , 液氨也存在与水类似的自偶电离,写出液氨的自偶电离方程式。结合H+能力的相对强弱:OH−(填“>”“<””或“=”)NH
OH−+ H3O + , 液氨也存在与水类似的自偶电离,写出液氨的自偶电离方程式。结合H+能力的相对强弱:OH−(填“>”“<””或“=”)NH  。
。
-
(4) 在某NaHSO3、Na2SO3混合溶液中HSO
 、SO
、SO  物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO 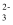 的水解平衡常数=。
的水解平衡常数=。 
下列热化学方程式中ΔH数值代表燃烧热的是( )
A . CH4(g)+2O2(g)=2H2O(1)+CO2(g) ΔH1
B . S(s)+ 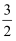 O2(g)=SO3(g) ΔH2
C . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(g) ΔH3
D . 2CO(g)+O2(g)=2CO2(g) ΔH4
O2(g)=SO3(g) ΔH2
C . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(g) ΔH3
D . 2CO(g)+O2(g)=2CO2(g) ΔH4
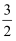 O2(g)=SO3(g) ΔH2
C . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(g) ΔH3
D . 2CO(g)+O2(g)=2CO2(g) ΔH4
O2(g)=SO3(g) ΔH2
C . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(g) ΔH3
D . 2CO(g)+O2(g)=2CO2(g) ΔH4
碳是形成化合物种类最多的元素,其单质及某些化合物是人类生产生活的主要能源物质。请回答下列问题:
-
(1) 有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6kJ·mol-1
ΔH=+88.6kJ·mol-1则M与N相比,较稳定的是 。
-
(2) 已知CH3OH(l)的燃烧热为726.5kJ·mol-1 , CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1则a726.5(填“>”“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1则a726.5(填“>”“<”或“=”)。
-
(3) 将Cl2和H2O(g)通过灼热的木炭层,生成HCl和CO2。当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:
-
(4) 火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅
烧,所得物质可作耐高温材料,反应的热化学方程式为:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176kJ·mol-1 , 则27g铝粉完全反应放出的热量为。
-
(5) 甲烷不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H1。已知某些化学键的键能数据如下表:
化学键
C—H
H—H
C≡O
O—H
键能/kJ·mol-1
413
436
1076
463
则△H1=kJ·mol-1
101kPa时,下列热化学方程式中的ΔH可表示燃烧热的是( )
A . C(s)+  O2(g)=CO(g) ΔH
B . H2(g)+
O2(g)=CO(g) ΔH
B . H2(g)+  O2(g)=H2O(g) ΔH
C . 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH
D . C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g) ΔH
O2(g)=H2O(g) ΔH
C . 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH
D . C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g) ΔH
 O2(g)=CO(g) ΔH
B . H2(g)+
O2(g)=CO(g) ΔH
B . H2(g)+  O2(g)=H2O(g) ΔH
C . 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH
D . C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g) ΔH
O2(g)=H2O(g) ΔH
C . 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH
D . C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g) ΔH
下列热化学方程式正确的是( )
A . 甲烷的燃烧热 , 则甲烷燃烧的热化学方程式可表示为:
, 则甲烷燃烧的热化学方程式可表示为: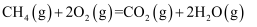
 B . 500℃、30MPa下,将0.5mol
B . 500℃、30MPa下,将0.5mol (g)和1.5mol
(g)和1.5mol (g)置于密闭容器中充分反应生成
(g)置于密闭容器中充分反应生成 (g),放热19.3kJ,其热化学方程式为
(g),放热19.3kJ,其热化学方程式为
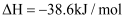 C . 增大反应物浓度,活化分子百分数增加大,单位时间内有效碰撞次数增多
D . 已知
C . 增大反应物浓度,活化分子百分数增加大,单位时间内有效碰撞次数增多
D . 已知
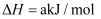 ,
, 
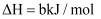 , 则a<b
, 则a<b
 , 则甲烷燃烧的热化学方程式可表示为:
, 则甲烷燃烧的热化学方程式可表示为: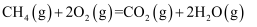
 B . 500℃、30MPa下,将0.5mol
B . 500℃、30MPa下,将0.5mol (g)和1.5mol
(g)和1.5mol (g)置于密闭容器中充分反应生成
(g)置于密闭容器中充分反应生成 (g),放热19.3kJ,其热化学方程式为
(g),放热19.3kJ,其热化学方程式为
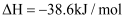 C . 增大反应物浓度,活化分子百分数增加大,单位时间内有效碰撞次数增多
D . 已知
C . 增大反应物浓度,活化分子百分数增加大,单位时间内有效碰撞次数增多
D . 已知
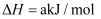 ,
, 
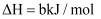 , 则a<b
, 则a<b
化学反应中的能量变化,通常主要表现为热量的变化。下列相关表述正确的是( )
A . 一定条件下,将 和
和 置于密闭容器中充分反应生成
置于密闭容器中充分反应生成 放热
放热 , 其热化学方程式为:
, 其热化学方程式为: B . 在
B . 在 时,
时, 完全燃烧生成液态水,放出
完全燃烧生成液态水,放出 热量,表示氢气燃烧热的热化学方程式表示为:
热量,表示氢气燃烧热的热化学方程式表示为: C .
C .  D .
D .  和
和 反应的中和热
反应的中和热 , 则
, 则 和足量
和足量 反应的
反应的
 和
和 置于密闭容器中充分反应生成
置于密闭容器中充分反应生成 放热
放热 , 其热化学方程式为:
, 其热化学方程式为: B . 在
B . 在 时,
时, 完全燃烧生成液态水,放出
完全燃烧生成液态水,放出 热量,表示氢气燃烧热的热化学方程式表示为:
热量,表示氢气燃烧热的热化学方程式表示为: C .
C .  D .
D .  和
和 反应的中和热
反应的中和热 , 则
, 则 和足量
和足量 反应的
反应的
最近更新



