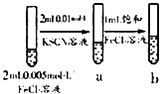原电池工作原理及应用 知识点题库


-
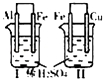
(1) AB两个装置中,属于原电池的是(填标号,下同).
-
(2) B池中,右边C是极,电极应式为:;
-
(3) A池中溶解了6.5g锌时,转移了mol电子.
实验 | 实验现象 | 结论 |
A |
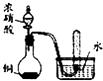
Ⅰ烧杯中铁表面有气泡Ⅱ烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B |
试管中收集到无色气体 | 铜与浓硝酸的反应产物是NO |
C |
试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
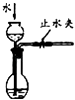
长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |


回答下列问题:
-
(1) 进入分解池中主要物质是;在合成塔中,若有4.4kgCO2与足量H2反应,生成气态的H2O和CH3OH,可放出5370kJ的热量,写出该反应的热化学方程式:。
-
(2) 该工艺在哪些方面体现了“绿色自由”构想中的“绿色”:①;②。
-
(3) 一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0 mol H2 , 在不同催化剂作用下,相同时间内CO2的转化率随温度变化如下图所示:

①催化剂效果最佳的是(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是。c点时该反应的平衡常数K=。
-
(4) 科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时的总反应方程式为。

-
(5) 已知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×10-ll , 则反应:HCO3- +H2O
 H2CO3+ OH-的平衡常数K=。
H2CO3+ OH-的平衡常数K=。

-
(1) 甲池是装置,通入CH4气体的电极上的反应式为。乙池中SO42- 移向电极(填“石墨”或“Ag”)
-
(2) 当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化mol,乙池若要恢复电解前的状态则需要加入g (填物质名称)。
-
(3) 丙池中发生的电解反应的离子方程式为。

-
(1) 甲中SO42-移向极(填“铝片”或“镁片”)。写出甲中负极的电极反应式。
-
(2) 乙中负极为,总反应的离子方程式:。此反应中氧化剂和还原剂的物质的量之比为,还原产物是。
-
(3) 原电池是把的装置。上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行性实验方案(如可靠,此空可不填)。
-
(1) 已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),△H=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g), △H=-566.0kJ/mol
③H2O(g)=H2O(l), △H=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式。
-
(2) 某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。

①甲池负极的电极反应为。
②工作一段时间后,测得甲中溶液的pH减小,该电池总反应的离子方程式为。
③乙池中A(石墨)电极的名称为(填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为。
④当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为mL(标准状况),假设乙池、丙池中的溶液均为足量,丙池中(填“C”或“D”)极析出g铜。
 固体为电解质传递
固体为电解质传递  ,其基本结构如图,电池总反应可表示为
,其基本结构如图,电池总反应可表示为  ,下列有关说法正确的是
,下列有关说法正确的是 


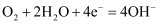 C . 每转移
C . 每转移 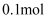 电子,消耗标准状况下
电子,消耗标准状况下  D .
D .  由a极通过固体酸电解质传递到b极
由a极通过固体酸电解质传递到b极
 Fe(OH)2+2Ni(OH)2 , 下列有关该电池的说法错误的是( )
Fe(OH)2+2Ni(OH)2 , 下列有关该电池的说法错误的是( )



 =2Zn+O2↑+4OH-+2H2O
B . 充电时,正极溶液中OH-浓度升高
C . 放电时,1molCO2转化为HCOOH,转移的电子数为2mol
D . 放电时,负极反应为Zn-2e-+4OH-=
=2Zn+O2↑+4OH-+2H2O
B . 充电时,正极溶液中OH-浓度升高
C . 放电时,1molCO2转化为HCOOH,转移的电子数为2mol
D . 放电时,负极反应为Zn-2e-+4OH-= 

-
(1) 图1装置是将能转化为能,若起始时左右两侧电极室溶液质量相等,当电路中有0.2mol电子发生转移时,左右两侧电极室溶液质量差为g。
-
(2) 用如图2所示的装置可消除雾霾中的NO、SO2。
①电极B为(填“阴极”或“阳极”)。
②电极A上发生的电极反应为。
-
(3) 图3中外电路中的电流方向为由(填“Al经导线流向Mg”或“Mg经导线流向Al”),Mg电极上发生的电极反应为;若要改变外电路中的电流方向,可将图3中KOH溶液换成(填标号)。
A.氨水 B.稀盐酸 C.蔗糖溶液
-
(4) 图4易发生(填“吸氧腐蚀”或“析氢腐蚀”),为了防止这类反应的发生,常采用的电化学方法进行保护。
 、
、  均为惰性电极。下列叙述错误的是( )
均为惰性电极。下列叙述错误的是( ) 
 极是负极,该电极上发生氧化反应
B . 电池总反应为
极是负极,该电极上发生氧化反应
B . 电池总反应为  C .
C .  极电极反应式为
极电极反应式为  D . 氢氧燃料电池是一种具有广阔应用前景的绿色电源
D . 氢氧燃料电池是一种具有广阔应用前景的绿色电源

 B . 铜为负极,发生氧化反应
C . 装置工作时,溶液中的
B . 铜为负极,发生氧化反应
C . 装置工作时,溶液中的  向铁极移动
D . 装置工作时每转移
向铁极移动
D . 装置工作时每转移 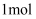 电子,将消耗
电子,将消耗 
-
(1) 甲同学探究反应Fe+H2SO4(稀)=FeSO4+H2↑中的能量变化。向装有铁片的试管中加入1 mol/L的H2SO4 , 观察到试管内有气泡产生,触摸试管外壁,温度升高。
①该反应为(填“放热”或“吸热”)反应。
②下列措施中,能加快氢气生成速率的是(填字母)。
a.将铁片改成铁粉 b.将稀H2SO4改成浓硫酸 c.加硫酸钠溶液
-
(2) 乙同学认为原电池原理也可加快化学反应速率,他设计如图1所示实验装置。实验过程中可观察到的现象是。铁片上的电极反应式为。

-
(3) 丙同学根据
 反应的发生条件,在老师的指导下,按如图2流程探究不同催化剂对NH3还原NO反应的催化性能。控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入一定体积滴有酚酞的稀硫酸中(溶液的体积、浓度均相同)。
反应的发生条件,在老师的指导下,按如图2流程探究不同催化剂对NH3还原NO反应的催化性能。控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入一定体积滴有酚酞的稀硫酸中(溶液的体积、浓度均相同)。 
①写出实验室用加热固体混合物的方法制备NH3的化学反应方程式。
②为比较不同催化剂的催化性能,需要测量并记录的数据是。
③在不同催化剂时测得混合气体中NH3的物质的量与时间的关系如图所示,则曲线(填序号)使用的催化剂催化性能最好,理由是。


 D . 将金属Zn换成金属Cu也能起到保护作用
D . 将金属Zn换成金属Cu也能起到保护作用