电镀 知识点题库
如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx . 该电池正极的电极反应式为.
用该电池作电源进行铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为 g.

某研究性学习小组将甲、乙、丙装置连接如图,除G、H外所有电极均为惰性电极。电解一段时间后,D电极质量增加。试回答下列问题:

-
(1) 电源A极是极(填“正”或“负”);乙装置F电极附近的现象是。
-
(2) 欲用丙装置给铜镀银。G应该是(填“Ag”或“Cu”)。
-
(3) 如用甲醇燃料电池(如图)充当电源,写出负极的电极反应方程式:;若用丁装置(如图)代替乙装置,写出丁装置中反应的总化学方程式是。
如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:

-
(1) 电极A是。(填“正极”或“负极”)
-
(2) 甲装置中电解反应的总化学方程式 。
-
(3) 若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56mL (标准状况下)气体,电解后溶液体积为500mL时,求所得溶液在25℃时的p=。
-
(4) 欲用丙装置给铜镀银。G应该是(填“银”或“铜”),电镀液的主要成分是(填化学式)
下列说法不正确的是( )
A . 电解精炼铜时溶液中的铜离子浓度会减少
B . 电镀时,应把镀件置于电解池的阴极
C . 为防止水闸铁门被腐蚀,可让其与直流电源的负极相连
D . 电化学防护中牺牲阳极的阴极保护法是利用了电解池原理
下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是( )
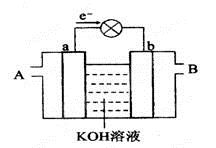
A . A处通入空气,B处通入水煤气
B . a电极的反应式包括:CO+4OH--2e-= CO32-+2H2O
C . a电极发生还原反应,b电极发生氧化反应
D . 如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气4.48 L
下列关于电解精炼铜与电镀的说法正确的是( )
A . 电解精炼铜时,将电能转化为化学能,电路中每通过2mole- , 阳极溶解64g铜
B . 可从阳极泥中提取金、银、锌等金属
C . 在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D . 电镀过程中电镀液需要不断更换
下列描述中,不符合生产实际的是( )
A . 电解饱和食盐H2O制烧碱,用离子交换膜将阳极室与阴极室隔开
B . 电解熔融的AlCl3制取金属铝,用石墨作阳极
C . 电解法精炼粗铜,用纯铜作阴极
D . 在Fe上镀银,用银作阳极
在铁制品上镀一定厚度的银层,以下方案设计正确的是( )
A . 银作阳极,镀件作阴极,溶液中含有银离子
B . 铂作阴极,镀件作阳极,溶液中含有锌离子
C . 铁作阳极,镀件作阴极,溶液中含有亚铁离子
D . 锌作阴极,镀件作阳极,溶液中含有亚铁离子
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应作( )
A . 负极
B . 阳极
C . 正极
D . 阴极
NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 1L0.1 mol·L-1NaClO溶液中含有的ClO-数目为NA
B . 在电解精炼粗铜的过程中,当阴极质量增重32g时转移的电子数为NA
C . 常温常压下,1 mol分子式为C2H6O的有机物中含有C-O键的数目为NA
D . 氢氧燃料电池正极消耗22.4 L气体时,负极消耗气体的分子数为2NA
下列电化学装置正确且能达到目的的是( )
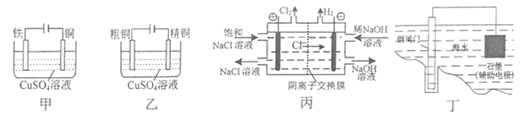
A . 用装置甲在铁制品表面镀铜
B . 用装置乙电解精炼铜
C . 用装置丙制备NaOH和氯气
D . 用装置丁保护钢闸门
利用如图所示装置(示意图),当X、Y选用不同材料时,可将电解原理广泛用于工业生产。下列说法中错误的是( )
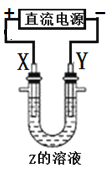
A . 氯碱工业中,Y附近能得到氢氧化钠溶液
B . 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C . 电镀工业中,Y是待镀金属,X是镀层金属
D . 外加电流的阴极保护法中,Y是待保护金属
某小组以软锰矿、闪锌矿为原料,尝试在铁钉表面镀锌及制取高纯  。流程如下:
。流程如下:
 。流程如下:
。流程如下: 
已知:①矿粉的主要成分是  、ZnS,还含有少量FeS、CuS、
、ZnS,还含有少量FeS、CuS、  等。
等。
②酸浸时反应之一:  。该生产过程中,
。该生产过程中,  与
与  不反应。
不反应。
③  的氧化性与溶液pH有关。
的氧化性与溶液pH有关。
请回答:
-
(1) 滤渣中加NaOH溶液可分离铁和铝,化学方程式是。
-
(2) 下列说法正确的是___________(填字母)。A . 可从步骤③的滤渣中回收S B . 步骤⑤,
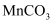 可换成
可换成  C . 步骤⑥,阳极材料可选择Fe
D . 多次过滤分离,可提高矿石利用价值
C . 步骤⑥,阳极材料可选择Fe
D . 多次过滤分离,可提高矿石利用价值
-
(3) 除杂时先加
 后加
后加 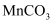 ,原因是。
,原因是。
-
(4) 小组同学欲用下列步骤测定铁钉表面镀层的锌的质量。请选出正确操作并排序(实验只进行一次,操作不重复):
称取一定质量的铁钉,放入烧杯中→()→()→()→()→()
a.加过量浓硫酸
b.加过量稀硫酸
c.置于坩埚中,小火烘干
d.置于石棉网上,小火烘干
e.取出,用蒸馏水洗涤
f.搅拌,至气泡速率突然减小
g.用电子天平称量
h.用托盘天平称量
-
(5) 测定
 产品的纯度:将
产品的纯度:将  固体研细,称取一定质量的产品至锥形瓶中,依次加入过量
固体研细,称取一定质量的产品至锥形瓶中,依次加入过量  固体、足量稀
固体、足量稀 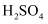 ,振荡至充分反应,再用
,振荡至充分反应,再用  标准溶液滴定剩余
标准溶液滴定剩余 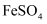 至终点。
至终点。 ①下列关于实验过程的说法,正确的是(填字母)。
A.先在滤纸上称量好
 粉末,再倒入锥形瓶
粉末,再倒入锥形瓶B.配制
 溶液时宜在棕色容量瓶中进行
溶液时宜在棕色容量瓶中进行C.“振荡至充分反应”时,锥形瓶须加塞密封
D.滴定时的指示剂是

E.滴定终点后仰视读数,会导致
 纯度偏大
纯度偏大②读取滴定管中
 溶液的示数时,因溶液颜色的干扰,凹液面最低点无法准确定位,此时可改为读取处的示数。
溶液的示数时,因溶液颜色的干扰,凹液面最低点无法准确定位,此时可改为读取处的示数。 -
(6) 电解时的总化学方程式为。
次磷酸钠(NaH2PO2)广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
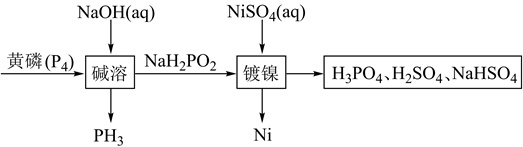
据此回答下列问题:
-
(1) 红磷与黄磷之间的关系为。
-
(2) 次磷酸钠中磷元素的化合价为。
-
(3) 写出碱溶过程的化学反应方程式,该反应中氧化剂与还原剂物质的量之比为。
-
(4) 已知次磷酸钠中的
 为四面体结构,请写出
为四面体结构,请写出  的结构式,次磷酸钠NaH2PO2为
的结构式,次磷酸钠NaH2PO2为  填“酸式盐”、“碱式盐”、“正盐”
填“酸式盐”、“碱式盐”、“正盐”  。
。
-
(5) 请简述化学镀镍的反应原理。
欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A . Ag和AgCl溶液
B . Ag和AgNO3溶液
C . Fe和AgNO3溶液
D . Pt和Ag2SO4溶液
模拟铁制品镀铜的装置如图,下列说法正确的是( )

A . a电极为铁制品
B . 可用CuSO4溶液作电镀液
C . b电极上发生氧化反应
D . 电镀过程中,理论上溶液中Cu2+浓度不断减小
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A . 铁制品做阳极,锌做阴极
B . 未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
C . 电镀时保持电流恒定,升高温度不改变电解反应速率
D . 镀锌层破损后即对铁制品失去保护作用
下列图示与对应的叙述相符的是( )
|
|
|
|
A.铁件镀银 | B.由褪色快慢研究反应物浓度对反应速率的影响 | C.稀硫酸与锌粒反应制氢气的能量变化 | D.蒸干硫酸铝溶液制无水硫酸铝固体 |
A . A
B . B
C . C
D . D
下列叙述不正确的是( )
A . 铁制品上镀铜:铁制品为阳极,铜盐为电镀液
B . 电解饱和食盐水,Cl-比OH-更易在阳极失去电子
C . 放电时,铅酸蓄电池中硫酸浓度不断变小
D . 外加电流法保护钢铁设备时,选用惰性辅助阳极
下列说法不正确的是( )
A . 提纯含有少量 的
的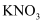 固体,可通过蒸发结晶、趁热过滤的方法
B . 取燃尽的火柴头加水浸泡,滴加
固体,可通过蒸发结晶、趁热过滤的方法
B . 取燃尽的火柴头加水浸泡,滴加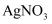 溶液和稀硝酸,可检测火柴头中的氯元素
C . 测定镀锌铁皮锌镀层厚度时,腐蚀后的铁皮烘干时间过长,测得结果偏低
D . 轻微烫伤时,可先用洁净的冷水洗涤伤处,再涂烫伤药膏
溶液和稀硝酸,可检测火柴头中的氯元素
C . 测定镀锌铁皮锌镀层厚度时,腐蚀后的铁皮烘干时间过长,测得结果偏低
D . 轻微烫伤时,可先用洁净的冷水洗涤伤处,再涂烫伤药膏
 的
的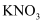 固体,可通过蒸发结晶、趁热过滤的方法
B . 取燃尽的火柴头加水浸泡,滴加
固体,可通过蒸发结晶、趁热过滤的方法
B . 取燃尽的火柴头加水浸泡,滴加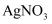 溶液和稀硝酸,可检测火柴头中的氯元素
C . 测定镀锌铁皮锌镀层厚度时,腐蚀后的铁皮烘干时间过长,测得结果偏低
D . 轻微烫伤时,可先用洁净的冷水洗涤伤处,再涂烫伤药膏
溶液和稀硝酸,可检测火柴头中的氯元素
C . 测定镀锌铁皮锌镀层厚度时,腐蚀后的铁皮烘干时间过长,测得结果偏低
D . 轻微烫伤时,可先用洁净的冷水洗涤伤处,再涂烫伤药膏
最近更新







