电镀 知识点题库
下列叙述不正确的是( )
A . 铁表面镀锌,铁作阳极
B . 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e–=4OH–
C . 船底镶嵌锌块,锌作负极,以防船体被腐蚀
D . 工业上电解饱和和食盐水的阴极反应:2H+ +2e –= H2↑
下列电化学有关说法中正确的是( )
A . 将钢闸门与直流电源的正极相连,可降低钢闸门腐蚀速率
B . 镀锌铁制品镀层受损后,铁制品仍不易生锈
C . 粗铜精炼时,电镀液中的c(Cu2+)保持不变
D . 纯银在空气中久置变黑发生的是电化学腐蚀
根据如图回答,下列说法不正确的是( )

A . 此装置用于铁表面镀铜时,a为铁
B . 此装置用于电镀铜时,硫酸铜溶液的浓度不变
C . 燃料电池中正极反应为  O2+2e﹣+2H+═H2O
D . 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
O2+2e﹣+2H+═H2O
D . 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
 O2+2e﹣+2H+═H2O
D . 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
O2+2e﹣+2H+═H2O
D . 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
如下图所示,装置Ⅰ为甲醇燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

-
(1) b处应通入(填“CH3OH”或“O2”),a处电极上发生的电极反应式是;
-
(2) 电镀结束后,装置Ⅰ中溶液的pH(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度;
-
(3) 若铜电极质量减小6.4 g,则消耗标况下的O2的体积为。
-
(4) 若将装置I中电解质溶液换成硫酸溶液,则在工作过程中H+ 移向电极(填“a”或“b”)。
我国现行流通的货币主要为第五套人民币,其中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为硬币制作时,钢芯应该做()
A . 阴极
B . 阳极
C . 正极
D . 负极
在铁制品上镀上一层锌层,以下电镀方案中合理的是( )
A . 锌作阳极,铁制品作阴极,溶液中含Fe2+
B . 锌作阴极,铁制品作阳极,溶液中含Zn2+
C . 锌作阴极,铁制品作阳极,溶液中含Fe3+
D . 锌作阳极,铁制品作阴极,溶液中含Zn2+
下列描述中,不符合生产实际的是( )
A . 电解熔融的氧化铝制取金属铝,用铜作阳极
B . 电解法精炼粗铜,用纯铜作阴极
C . 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D . 在镀件上电镀锌,用锌作阳极
关于镀铜和电解精炼铜,下列说法中正确的是( )
A . 都用粗铜作阳极、纯铜作阴极
B . 电解液的成分都保持不变
C . 阳极反应都只有Cu-2e-=Cu2+
D . 阴极反应都只有Cu2++2e-=Cu
电解精炼铜和电镀,阳极分别是( )
A . 粗铜、镀层
B . 粗铜、镀件
C . 精铜、镀层
D . 精铜、镀件
下列有关电化学在生产、生活中的应用分析正确的是( )

A . 图1:铁钉发生析氢腐蚀
B . 图2:可以在铁件上镀铜
C . 图3:溶液中c(Cu2+)保持不变
D . 图4:将输油管与电源负极相连可以防止腐蚀
下列叙述错误的是( )
A . 电解池的阳极上发生氧化反应,阴极上发生还原反应
B . 原电池跟电解池连接后,电子从原电池的负极流向电解池的阴极,经过溶液到达电解池的阳极,然后再回流到原电池的正极
C . 电镀时,电镀池中的阳极发生氧化反应
D . 用惰性电极电解饱和食盐水时,在阴极区得到氢氧化钠溶液和氢气
下列有关铜片镀银的说法错误的是( )
A . 阳极反应式为Ag-e-=Ag+
B . 铜片应与电源正极相连
C . 电解液为AgNO3溶液
D . 镀银过程中电能转化为化学能
在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法错误的是( )
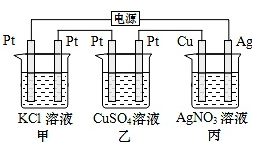
A . 标准状况下当甲中产生4.48L气体时,丙中Cu电极质量增加21.6g
B . 电解过程中丙中溶液pH无变化
C . 向甲中加入适量的盐酸,可使溶液恢复到电解前的状态
D . 乙中左侧电极反应式:Cu2++2e-=Cu
Ni常被镀在金属制品上以保护金属不生锈。
-
(1) 镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。
①待镀零件与电源相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)Ni2++H2PO2-+→Ni ++H2PO3-+,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑

上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。
-
(2) LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2 , 该反应的化学方程式为,加热温度不宜过高的原因是,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是。
-
(3) 以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:

已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Al(OH)3]=1.0×10-33 , Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii.(用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?(列式计算,并使用必要的文字说明)。
下列关于铜电极的叙述错误的是( )
A . 锌铜原电池中铜是正极
B . 在镀件上镀铜时可用金属铜作阳极
C . 用电解法精炼粗铜时粗铜作阳极
D . 将铜板与地下钢管相连,可保护地下钢管不受腐蚀
下列描述中,不符合生产实际的是( )
A . 电解熔融的氧化铝制取金属铝
B . 电解法精炼粗铜,用粗铜作阴极
C . 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D . 在镀件上电镀锌,用锌作阳极
关于下列各装置图的叙述错误的( )
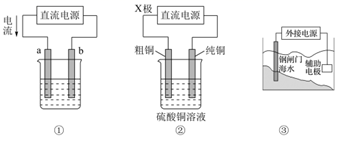
A . 图①装置可实现铁上镀铜,则a极为铜,b极为铁
B . 图②装置可实现粗铜的精炼,则X极为正极
C . 图①装置可用于氯碱工业,则电极总反应式为:2Cl-+2H2O  H2↑+Cl2↑+2OH-
D . 图③装置中钢闸门应与外接电源的负极相连以实现牺牲阳极的阴极保护法
H2↑+Cl2↑+2OH-
D . 图③装置中钢闸门应与外接电源的负极相连以实现牺牲阳极的阴极保护法
 H2↑+Cl2↑+2OH-
D . 图③装置中钢闸门应与外接电源的负极相连以实现牺牲阳极的阴极保护法
H2↑+Cl2↑+2OH-
D . 图③装置中钢闸门应与外接电源的负极相连以实现牺牲阳极的阴极保护法
一种高温熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A . 如用此种电池电镀铜,待镀铜金属上增重 19.2 g,则应消耗2.24 LCH4
B . 电极 A 上 H2参与的电极反应为:  C . 电池工作时,CO
C . 电池工作时,CO  向电极B移动
D . 电极 B上发生的电极反应为:
向电极B移动
D . 电极 B上发生的电极反应为: 
 C . 电池工作时,CO
C . 电池工作时,CO  向电极B移动
D . 电极 B上发生的电极反应为:
向电极B移动
D . 电极 B上发生的电极反应为: 
下列说法正确的是( )
A . 氯气与氢气在光照下反应生成 , 工业常用此方法生产盐酸
B .
, 工业常用此方法生产盐酸
B .  通入氨的饱和
通入氨的饱和 溶液中生成
溶液中生成 沉淀
C . 控制合适的条件,可实现在铁皮表面电镀锡
D .
沉淀
C . 控制合适的条件,可实现在铁皮表面电镀锡
D .  隔绝空气高温分解,产物为
隔绝空气高温分解,产物为 和
和
 , 工业常用此方法生产盐酸
B .
, 工业常用此方法生产盐酸
B .  通入氨的饱和
通入氨的饱和 溶液中生成
溶液中生成 沉淀
C . 控制合适的条件,可实现在铁皮表面电镀锡
D .
沉淀
C . 控制合适的条件,可实现在铁皮表面电镀锡
D .  隔绝空气高温分解,产物为
隔绝空气高温分解,产物为 和
和
下列说法中,不符合生产、生活实际的是( )
A . 在镀件上电镀锌用锌作阳极
B . 用铜作阳极电解饱和食盐水制取 C . 电解法精炼粗铜,用纯铜作阴极
D . 地下钢管连接镁块,保护钢管不被腐蚀
C . 电解法精炼粗铜,用纯铜作阴极
D . 地下钢管连接镁块,保护钢管不被腐蚀
 C . 电解法精炼粗铜,用纯铜作阴极
D . 地下钢管连接镁块,保护钢管不被腐蚀
C . 电解法精炼粗铜,用纯铜作阴极
D . 地下钢管连接镁块,保护钢管不被腐蚀
最近更新



