电解池工作原理及应用 知识点
电解池应用:提纯金属,比如电解精炼铜,保护金属,将某种不易被氧化金属镀到活泼的金属上,保护金属,称为电镀。
电解池工作原理及应用 知识点题库
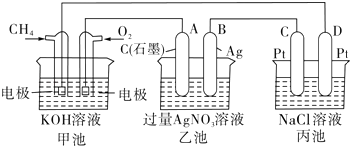
-
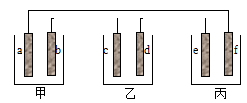
(1) 甲池是装置,电极A的名称是.
-
(2) 甲装置中通入CH4的电极反应式为,乙装置中B(Ag)的电极反应式为,丙装置中D极的产物是(写化学式),
-
(3) 一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=.(已知:NaCl溶液足量,电解后溶液体积为500mL).若要使丙池恢复电解前的状态,应向丙池中通入(写化学式).
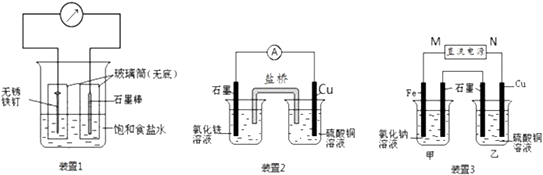
-
(1) 装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为.
-
(2) 装置2中的石墨是极(填“正”或“负”)
-
(3) 装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为极;铁电极的电极反应
②停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为 mL.
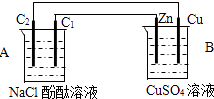
-
(1) 判断装置的名称:A池为.
-
(2) 锌电极反应式为,石墨棒C1为极,电极反应式为,石墨棒C2附近发生的实验现象为.
-
(3) 当C2极析出2.24L气体(标准状态)时,锌的质量减少了g.CuSO4溶液的质量增加了g.
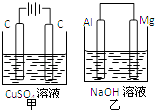
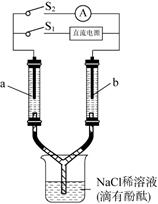
②乙中为 100 mL NaCl 溶液(足量),滴有酚酞,丙为 CuSO4 溶液。
③若 c、d 为惰性电极,通电时 c 电极附近首先出现红色。 请回答下列问题:
-
(1) b 处通入(填“CH4”或“O2”),电极反应式为:。
-
(2) 当乙中 pH=13 时,a 处通入标准状况下mL 的气体(填“O2”或 “CH4”),c 电极的电极反应式为:。
-
(3) 若用丙装置在 Fe 上镀 Cu,则 e 为(填“Fe”或“Cu”),若 e,f 为惰性电极, 写出电解反应的离子方程式:。若 e,f 为惰性电极,丙中溶液为不饱和 Na2CO3 溶液, 则电解过程中pH(填“变大”、“不变”或“变小”),原因是。
已知:3I2+6OH-=IO3-+5I-+3H2O
下列说法错误的是( )
下列分析错误的是( )
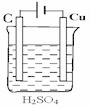 B .
B . 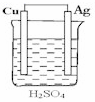 C .
C . 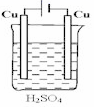 D .
D . 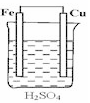
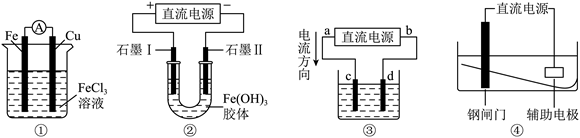
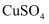 溶液,电解过程其浓度不变
D . 装置④中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法
溶液,电解过程其浓度不变
D . 装置④中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法
-
(1) I.某同学在实验室中组装下列实验装置并进行实验探究。
该同学观察到甲装置中的液面变化情况为,长期放置后铁钉a表面逐渐生成铁锈,铁锈主要成分的化学式为。
-
(2) 反应过程中观察到乙装置中左边液面降低,右边液面升高,装置中发生原电池反应,正极的电极反应式为。若将乙装置中的铜丝换成铝丝,此时铁钉b被保护而不被腐蚀,此方法被称为。
-
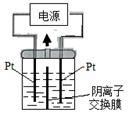
(3) II.工业上使用离子交换膜电解槽电解饱和食盐水生产氯气等重要化工产品。
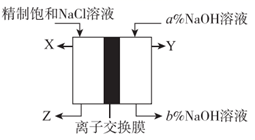
电解槽左侧为(填“阳极室”或“阴极室”)。
-
(4) X和Y是气态物质,其中是H2。
-
(5) 由图可知,a和b的关系为ab(填“>”“ <”或“=”)。
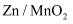 液流电池的工作原理如图所示。电池以锌箔、石墨毡为集流体,
液流电池的工作原理如图所示。电池以锌箔、石墨毡为集流体, 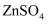 和
和 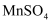 的混合液作电解质溶液,下列说法正确的是( )
的混合液作电解质溶液,下列说法正确的是( ) 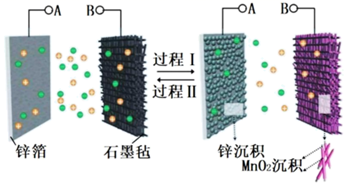
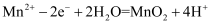 D . 放电时,当外电路转移
D . 放电时,当外电路转移 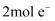 时,两电极质量变化的差值为98g
时,两电极质量变化的差值为98g
-
(1) 一种节能技术是将电解池与燃料电池相组合,相关物料传输与转化关系如下图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过。
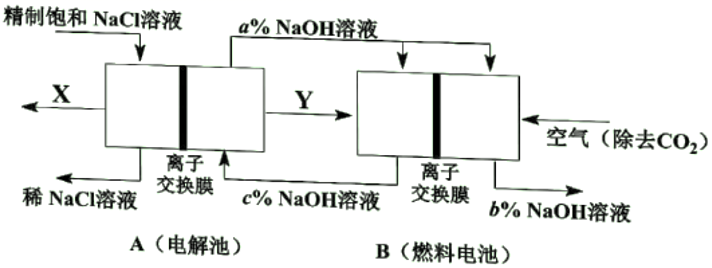
①当产生0.5molX时,A中通过离子交换膜的Na+有mol。
②写出燃料电池B中负极上的电极反应式。
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序。
-
(2) 降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2 , 避免水电离的H+直接得电子生成H2 , 降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应式为。
-
(1) 以CO2和H2为原料合成乙烯,其反应的过程分两步进行:
I.CO2(g)+H2(g)→CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
II.2CO(g)+4H2(g)→C2H4(g)+2H2O(g) ΔH=+210.5kJ·mol-1
CO2加氢合成乙烯的热化学方程式为。
-
(2) 2021年9月24日,我国科学家在《Science》上发表论文《无细胞化学酶法从二氧化碳合成淀粉》,代表着人类人工合成淀粉领域的重大颠覆性和原创性突破。该实验方法首先将CO2催化还原为CH3OH。探究CH3OH合成反应的化学平衡影响因素,有利于提高CH3OH的产率。CO2和H2在某种催化剂作用下可同时发生以下两个反应:
I.CO2(g)+3H2(g)→CH3OH(g)+H2O(g) ΔH=-48.5kJ·mol-1
II.2CO2(g)+5H2(g)→C2H2(g)+4H2O(g) ΔH=+37.1kJ·mol-1
在压强为P,CO2、H2的起始投料为1:3的条件下,发生反应I、II。实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度的变化如图所示。
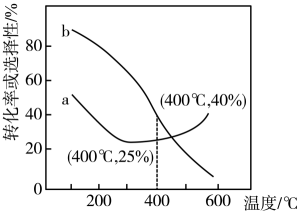
已知:CH3OH的选择性=

①有利于提高CH3OH的选择性的措施有(填序号)。
A.适当降温
B.适当升温
C.选择合适的催化剂
②温度高于350℃时,体系中发生的反应以 (填“I”或“II”)为主,并说明理由。
③其中表示平衡时CH3OH的选择性的曲线是 (填“a”或“b”)。
④400℃时,在该压强及投料比的条件下,利用图示所给数据计算H2的转化率为 (保留三位有效数字)。
-
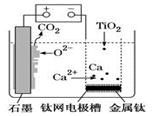
(3) 二氧化碳甲烷化技术是一种最有效的对二氧化碳循环再利用的技术。用如图装置电解二氧化碳制取甲烷,温度控制在10℃左右,持续通入二氧化碳,电解过程中KHCO3物质的量基本不变。

①阴极反应为。
②阳极产生的气体是(写化学式)。
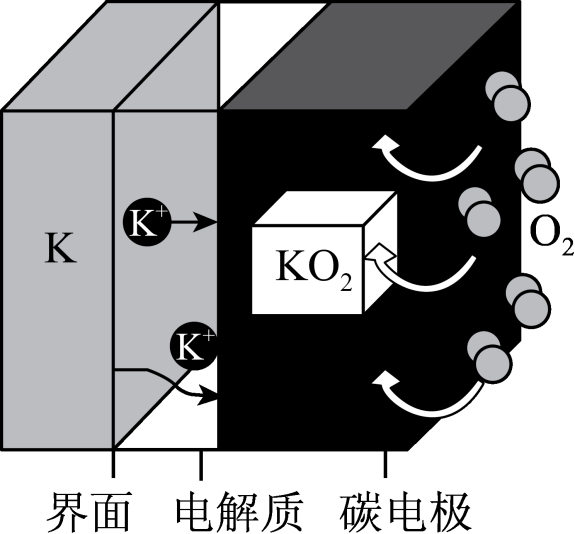

 )的熔融碳酸盐中电解甲烷的方法,实现了无水、零排放的方式生产
)的熔融碳酸盐中电解甲烷的方法,实现了无水、零排放的方式生产 和C,反应原理如图所示。下列说法错误的是( )
和C,反应原理如图所示。下列说法错误的是( )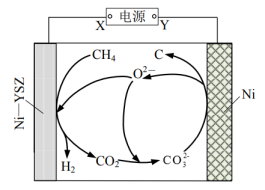
 电极上发生的电极反应方程式为
电极上发生的电极反应方程式为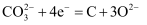 C . 该条件下,每产生22.4L
C . 该条件下,每产生22.4L , 电路中转移
, 电路中转移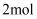 电子
D . 电解一段时间后熔融盐中
电子
D . 电解一段时间后熔融盐中 的物质的量不变
的物质的量不变
 可获得难溶性的
可获得难溶性的 和
和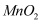 , 电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是( )
, 电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是( )

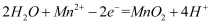 C . 电解一段时间后溶液中
C . 电解一段时间后溶液中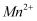 浓度保持不变
D . 电解结束,可通过调节
浓度保持不变
D . 电解结束,可通过调节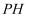 除去
除去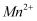 , 再加入
, 再加入 溶液以获得
溶液以获得



