з”өи§Јжұ е·ҘдҪңеҺҹзҗҶеҸҠеә”з”Ё зҹҘиҜҶзӮ№йўҳеә“

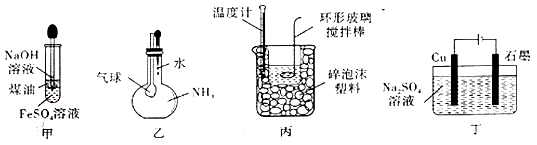
в‘ з”өжһҒaжҳҜжһҒпјӣ
в‘Ўз”Ізҡ„еҢ–еӯҰејҸжҳҜпјӣ
в‘ўз”өжһҒbзҡ„з”өжһҒеҸҚеә”ејҸжҳҜпјҺ


-
пјҲ1пјү з”ІиЈ…зҪ®дёӯйҖҡе…ҘCH4зҡ„з”өжһҒеҸҚеә”ејҸдёәпјҢ
-
пјҲ2пјү д»ҺиғҪйҮҸиҪ¬еҢ–зҡ„и§’еәҰеҲҶжһҗпјҢд№ҷжұ жҳҜиҪ¬еҢ–дёәзҡ„иЈ…зҪ®пјҺ
-
пјҲ3пјү дёҖж®өж—¶й—ҙпјҢеҪ“дёҷжұ дёӯдә§з”ҹ112mLпјҲж ҮеҮҶзҠ¶еҶөдёӢпјүж°”дҪ“ж—¶пјҢеқҮеҢҖжҗ…жӢҢдёҷжұ пјҢжүҖеҫ—жә¶ж¶ІеңЁ25в„ғж—¶зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәпјҺпјҲе·ІзҹҘпјҡNaClжә¶ж¶Іи¶ійҮҸпјҢз”өи§ЈеҗҺжә¶ж¶ІдҪ“з§Ҝдёә500mLпјүпјҺ
-
пјҲ4пјү иӢҘиҰҒдҪҝдёҷжұ жҒўеӨҚз”өи§ЈеүҚзҡ„зҠ¶жҖҒпјҢеә”еҗ‘дёҷжұ дёӯйҖҡе…ҘпјҲеҶҷеҢ–еӯҰејҸпјүпјҺ

-
пјҲ1пјү дёҠиҝ°еӣӣз§ҚиЈ…зҪ®дёӯпјҢдёәз”өи§Јжұ зҡ„жҳҜВ пјҲз”Ёзј–еҸ·еӣһзӯ”пјүпјҢиЈ…зҪ®в‘ЎдёӯдёӨз”өжһҒзҡ„з”өжһҒеҸҚеә”ејҸеҲҶеҲ«жҳҜпјҡZnжһҒпјҡпјҢCuжһҒпјҡпјҺ
-
пјҲ2пјү иЈ…зҪ®в‘ЈдёӯпјҢйҖҡз”өдёҖејҖе§ӢпјҢFeжһҒдёҠеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”ејҸжҳҜпјӣCжһҒдёҠеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”ејҸжҳҜпјҺ
-
пјҲ3пјү е·ҘдҪңдёҖж®өж—¶й—ҙеҗҺпјҢжөӢеҫ—еҜјзәҝдёҠеқҮйҖҡиҝҮ0.002molз”өеӯҗпјҢеҲҷдёҠиҝ°иЈ…зҪ® в‘Ўдёӯз”ҹжҲҗж°”дҪ“зҡ„дҪ“з§ҜжҳҜВ mLпјҲжә¶ж¶ІдҪ“з§ҜеҸҳеҢ–еҝҪз•ҘдёҚи®ЎпјүпјҺ

-
пјҲ1пјү е·ІзҹҘпјҡ
в‘ 2CH3OHпјҲlпјү+3O2пјҲgпјү=2CO2пјҲgпјү+4H2OпјҲgпјүв–іH1=п№Ј1274.0kJ/mol
в‘Ў2COпјҲgпјү+O2пјҲgпјү=2CO2пјҲgпјүв–іH2=п№Ј566.0kJ/mol в‘ўH2OпјҲgпјү=H2OпјҲlпјүв–іH3=п№Ј44kJ/molпјҺ з”ІйҶҮдёҚе®Ңе…ЁзҮғзғ§з”ҹжҲҗдёҖж°§еҢ–зўіе’Ңж¶ІжҖҒж°ҙзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәпјҡпјҺ
-
пјҲ2пјү еҸҜеҲ©з”Ёз”ІйҶҮзҮғзғ§еҸҚеә”и®ҫи®ЎдёҖдёӘзҮғж–ҷз”өжұ пјҺеҰӮеӣҫ1пјҢз”ЁPtдҪңз”өжһҒжқҗж–ҷпјҢз”Ёж°ўж°§еҢ–й’ҫжә¶ж¶ІдҪңз”өи§ЈиҙЁжә¶ж¶ІпјҢеңЁдёӨдёӘз”өжһҒдёҠеҲҶеҲ«е……е…Ҙз”ІйҶҮе’Ңж°§ж°”пјҺ
в‘ еҶҷеҮәзҮғж–ҷз”өжұ иҙҹжһҒзҡ„з”өжһҒеҸҚеә”ејҸпјҺ
в‘ЎиӢҘеҲ©з”ЁиҜҘзҮғж–ҷз”өжұ жҸҗдҫӣз”өжәҗпјҢдёҺеӣҫ2еҸіиҫ№зғ§жқҜзӣёиҝһпјҢеңЁй“Ғ件表йқўй•Җй“ңпјҢеҲҷй“Ғ件еә”жҳҜжһҒпјҲеЎ«вҖқAвҖқжҲ–вҖқBвҖқпјүпјӣеҪ“й“Ғ件зҡ„иҙЁйҮҸеўһйҮҚ6.4gж—¶пјҢзҮғж–ҷз”өжұ дёӯж¶ҲиҖ—ж°§ж°”зҡ„ж ҮеҮҶзҠ¶еҶөдёӢдҪ“з§Ҝдёә LпјҺ
-
пјҲ3пјү жҹҗз ”з©¶е°Ҹз»„е°ҶдёӨдёӘз”Ізғ·зҮғж–ҷз”өжұ дёІиҒ”еҗҺдҪңдёәз”өжәҗпјҢиҝӣиЎҢйҘұе’Ңж°ҜеҢ–й’ жә¶ж¶Із”өи§Је®һйӘҢиӢҘжҜҸдёӘз”өжұ з”Ізғ·йҖҡе…ҘйҮҸдёә1LпјҲж ҮеҮҶзҠ¶еҶөпјүпјҢдё”еҸҚеә”е®Ңе…ЁпјҢеҲҷзҗҶи®әдёҠйҖҡиҝҮз”өи§Јжұ зҡ„з”өйҮҸдёәпјҲжі•жӢү第常数F=9.65Г—104C/molпјүпјҢжңҖеӨҡиғҪдә§з”ҹзҡ„ж°Ҝж°”дҪ“з§Ҝдёә LпјҲж ҮеҮҶзҠ¶еҶөпјүпјҺ
-
пјҲ4пјү з”өи§Јжі•еҸҜж¶ҲйҷӨз”ІйҶҮеҜ№ж°ҙиҙЁйҖ жҲҗзҡ„жұЎжҹ“пјҢеҺҹзҗҶжҳҜпјҡйҖҡз”өе°ҶCo2+ж°§еҢ–жҲҗCo3+ пјҢ 然еҗҺе°Ҷз”ІйҶҮж°§еҢ–жҲҗCO2е’ҢH+пјҲз”ЁзҹіеўЁзғҜйҷӨеҺ»Co2+пјүзҺ°з”ЁеҰӮеӣҫ3жүҖзӨәиЈ…зҪ®жЁЎжӢҹдёҠиҝ°иҝҮзЁӢпјҢеҲҷCo2+еңЁйҳіжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёә
йҷӨеҺ»з”ІйҶҮзҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҺ

-
пјҲ1пјү еҶҷеҮәAжһҒзҡ„з”өжһҒж–№зЁӢејҸпјҡгҖӮ
-
пјҲ2пјү з”Іжұ дёӯBз”өжһҒзҗҶи®әдёҠж¶ҲиҖ—O2зҡ„дҪ“з§ҜпјҲж ҮеҮҶзҠ¶еҶөдёӢпјүдёәеӨҡе°‘жҜ«еҚҮ?
-
пјҲ3пјү иӢҘдёҷжұ дёӯжә¶ж¶Ізҡ„дҪ“з§Ҝдёә1000 mLпјҢжӯӨж—¶дёҷжұ дёӯжә¶ж¶Ізҡ„pHдёәеӨҡе°‘пјҹ

 Cu(OH)2+H2вҶ‘
Cu(OH)2+H2вҶ‘



-
пјҲ1пјү й“ҒзҰ»еӯҗжө“еәҰжҳҜеҺҹжІ№еҠ е·ҘдёӯйҳІи…җзӣ‘жөӢзҡ„йҮҚиҰҒжҢҮж ҮгҖӮжөӢе®ҡй“ҒзҰ»еӯҗжө“еәҰеүҚпјҢйңҖеҺ»йҷӨеҺҹжІ№еҠ е·Ҙдә§з”ҹзҡ„й…ёжҖ§еәҹж°ҙдёӯзҡ„зЎ«еҢ–ж°ўеҸҠе…¶зӣҗгҖӮе®һйӘҢе®ӨжЁЎжӢҹиҝҮзЁӢеҰӮдёӢгҖӮ
в… пјҺе°Ҷ250mLй…ёжҖ§еәҹж°ҙзҪ®дәҺеҸҚеә”瓶дёӯпјҢеҠ е…Ҙе°‘йҮҸжө“зӣҗй…ёпјҢи°ғиҠӮpHе°ҸдәҺ5гҖӮ
в…ЎпјҺеңЁеҗёж”¶з“¶дёӯеҠ е…ҘйҘұе’Ңж°ўж°§еҢ–й’ жә¶ж¶ІгҖӮ
в…ўпјҺжү“ејҖи„ұж°”вҖ”еҗёж”¶иЈ…зҪ®пјҢйҖҡе…Ҙж°®ж°”пјҢи°ғиҠӮж°”жөҒйҖҹеәҰпјҢдҪҝж°”дҪ“дҫқж¬Ўз»ҸиҝҮеҸҚеә”瓶е’Ңеҗёж”¶з“¶гҖӮеҪ“еҗ№еҮәж°”дҪ“дёӯH2SдҪ“з§ҜеҲҶж•°иҫҫеҲ°ж ҮеҮҶпјҢеҚіеҸҜеҒңжӯўеҗ№ж°”гҖӮ
е·ІзҹҘпјҡеҗ«зЎ«еҫ®зІ’зҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°пјҲОҙпјүйҡҸpHеҸҳеҢ–жғ…еҶөеҰӮдёӢеӣҫжүҖзӨәгҖӮ

в‘ жӯҘйӘӨв… дёӯеҠ е…Ҙжө“зӣҗй…ёи°ғиҠӮpHпјң5зҡ„еҺҹеӣ жҳҜгҖӮ
в‘ЎжӯҘйӘӨв…ЎдёӯпјҢеҪ“жөӢеҫ—еҗёж”¶ж¶Ізҡ„pHдёә ж—¶пјҢйңҖиҰҒжӣҙжҚўNaOHжә¶ж¶ІгҖӮ
в‘ўеҲ©з”ЁйӮ»иҸІзҪ—е•үеҲҶе…үе…үеәҰжі•еҸҜжөӢе®ҡж ·е“Ғдёӯзҡ„еҗ«й“ҒйҮҸгҖӮжөӢе®ҡеүҚйңҖз”Ёзӣҗй…ёзҫҹеҹәиғәпјҲNH2OHВ·HClпјүе°ҶFe3+иҝҳеҺҹдёәFe2+гҖӮе°ҶдёӢиҝ°зҰ»еӯҗж–№зЁӢејҸиЎҘе……е®Ңж•ҙпјҡFe3++NH2OHВ·HCl=Fe2++N2вҶ‘+++Cl-
-
пјҲ2пјү еҺҹжІ№дёӯзҡ„зЎ«еҢ–ж°ўиҝҳеҸҜйҮҮз”Ёз”өеҢ–еӯҰжі•еӨ„зҗҶпјҢ并еҲ¶еҸ–ж°ўж°”пјҢе…¶еҺҹзҗҶеҰӮдёӢеӣҫжүҖзӨәгҖӮ

в‘ еҶҷеҮәеҸҚеә”жұ еҶ…еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
в‘Ўз”өи§Јжұ дёӯпјҢйҳіжһҒзҡ„з”өжһҒеҸҚеә”дёәгҖӮ
 жә¶ж¶Іе……еҲҶж¶Ұж№ҝ,иҝӣиЎҢеҰӮдёӢе®һйӘҢ:
жә¶ж¶Іе……еҲҶж¶Ұж№ҝ,иҝӣиЎҢеҰӮдёӢе®һйӘҢ:

е®һйӘҢзҺ°иұЎ:
|
ж—¶й—ҙ |
иҜ•зәёI |
иҜ•зәёII |
|
1min |
aжһҒйҷ„иҝ‘иҜ•зәёеҸҳзәў,bжһҒйҷ„иҝ‘иҜ•зәёеҸҳи“қ |
cжһҒйҷ„иҝ‘иҜ•зәёеҸҳзәў,dжһҒйҷ„иҝ‘вҖҰвҖҰ |
|
10min |
зәўиүІеҢәе’Ңи“қиүІеҢәдёҚж–ӯеҗ‘дёӯй—ҙжү©еұ•,зӣёйҒҮж—¶зәўиүІеҢәзәҰ2.7cm,и“қиүІеҢәзәҰ1.3cm |
дёӨжһҒйўңиүІиҢғеӣҙжү©еӨ§дёҚжҳҺжҳҫ,иҜ•зәёеӨ§йғЁеҲҶд»Қдёәй»„иүІ |
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ( )
 зҡ„иҝҒ移йҖҹзҺҮжҜ”OH-еҝ«
зҡ„иҝҒ移йҖҹзҺҮжҜ”OH-еҝ«
M+N  Q
Q  Qжә¶ж¶І
Qжә¶ж¶І  M+N
M+N
a.  b.
b. 
c.  d.
d. 

 2PbпјҲBF4пјү2+2H2OпјҢPbпјҲBF4пјү2дёәеҸҜжә¶дәҺж°ҙзҡ„ејәз”өи§ЈиҙЁгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
2PbпјҲBF4пјү2+2H2OпјҢPbпјҲBF4пјү2дёәеҸҜжә¶дәҺж°ҙзҡ„ејәз”өи§ЈиҙЁгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
-
пјҲ1пјү NOеҠ йҖҹиҮӯж°§еұӮиў«з ҙеқҸпјҢе…¶еҸҚеә”иҝҮзЁӢеҰӮеӣҫжүҖзӨәпјҡ

еҸҚеә”O3(g)пјӢO(g)=2O2(g) вҲҶH=вҲ’143kJ/mol
еҸҚеә”1пјҡO3(g)пјӢNO(g)=NO2(g)пјӢO2(g) вҲҶH1=вҲ’200.2kJ/mol
еҸҚеә”2пјҡзғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ2пјү в‘ жұҪиҪҰеҸ‘еҠЁжңәе·ҘдҪңж—¶дјҡеј•еҸ‘еҸҚеә”N2(g)пјӢO2(g)
 2NO(g)гҖӮ2000Kж—¶пјҢеҗ‘еӣәе®ҡе®№з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯе……е…Ҙзӯүзү©иҙЁзҡ„йҮҸзҡ„N2гҖҒO2еҸ‘з”ҹдёҠиҝ°еҸҚеә”пјҢеҗ„з»„еҲҶдҪ“з§ҜеҲҶж•°(ПҶ)зҡ„еҸҳеҢ–еҰӮеӣҫ1жүҖзӨәгҖӮN2зҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёәгҖӮ
2NO(g)гҖӮ2000Kж—¶пјҢеҗ‘еӣәе®ҡе®№з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯе……е…Ҙзӯүзү©иҙЁзҡ„йҮҸзҡ„N2гҖҒO2еҸ‘з”ҹдёҠиҝ°еҸҚеә”пјҢеҗ„з»„еҲҶдҪ“з§ҜеҲҶж•°(ПҶ)зҡ„еҸҳеҢ–еҰӮеӣҫ1жүҖзӨәгҖӮN2зҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёәгҖӮ 
в‘ЎеңЁеҜҶй—ӯгҖҒеӣәе®ҡе®№з§Ҝзҡ„е®№еҷЁдёӯпјҢдёҖе®ҡйҮҸNOеҸ‘з”ҹеҲҶи§Јзҡ„иҝҮзЁӢдёӯпјҢNOзҡ„иҪ¬еҢ–зҺҮйҡҸж—¶й—ҙеҸҳеҢ–е…ізі»еҰӮеӣҫ2жүҖзӨәгҖӮеҸҚеә”2NO(g)
 N2(g)пјӢO2(g) вҲҶH0(еЎ«вҖң>вҖқжҲ–вҖң<вҖқ)гҖӮ
N2(g)пјӢO2(g) вҲҶH0(еЎ«вҖң>вҖқжҲ–вҖң<вҖқ)гҖӮ
-
пјҲ3пјү еҲ©з”Ёи„ұж°®иҸҢеҸҜеҮҖеҢ–дҪҺжө“еәҰNOеәҹж°”гҖӮеҪ“еәҹж°”еңЁеЎ”еҶ…еҒңз•ҷж—¶й—ҙеқҮдёә90sзҡ„жғ…еҶөдёӢпјҢжөӢеҫ—дёҚеҗҢжқЎд»¶дёӢNOзҡ„и„ұж°®зҺҮеҰӮеӣҫIгҖҒIIжүҖзӨәгҖӮ

в‘ з”ұеӣҫIзҹҘпјҢеҪ“еәҹж°”дёӯзҡ„NOеҗ«йҮҸеўһеҠ ж—¶пјҢе®ңйҖүз”Ёжі•жҸҗй«ҳи„ұж°®зҡ„ж•ҲзҺҮгҖӮ
в‘ЎеӣҫIIдёӯпјҢеҫӘзҺҜеҗёж”¶ж¶ІеҠ е…ҘFe2+гҖҒMn2+ пјҢ жҸҗй«ҳдәҶи„ұж°®зҡ„ж•ҲзҺҮпјҢе…¶еҸҜиғҪеҺҹеӣ дёәгҖӮ
-
пјҲ4пјү з ”з©¶иЎЁжҳҺпјҡNaClO/H2O2й…ёжҖ§еӨҚеҗҲеҗёж”¶еүӮеҸҜеҗҢж—¶жңүж•Ҳи„ұзЎқгҖӮеӣҫIIIжүҖзӨәдёәеӨҚеҗҲеҗёж”¶еүӮз»„жҲҗдёҖе®ҡж—¶пјҢжё©еәҰеҜ№и„ұзЎқзҡ„еҪұе“ҚгҖӮжё©еәҰй«ҳдәҺ60в„ғеҗҺпјҢNOеҺ»йҷӨзҺҮдёӢйҷҚзҡ„еҺҹеӣ дёәгҖӮ
-
пјҲ5пјү з”өи§ЈNOеҲ¶еӨҮNH4NO3 пјҢ жҳҜеӨ„зҗҶж°Ёж°§еҢ–зү©зҡ„жҺ’ж”ҫзҡ„ж–№жі•д№ӢдёҖпјҢеҸ‘з”ҹеҸҚеә”8NOпјӢ7H2O
 3NH4NO3пјӢ2HNO3 пјҢ е…¶е·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҡ
3NH4NO3пјӢ2HNO3 пјҢ е…¶е·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҡ 
в‘ йҳҙжһҒзҡ„з”өжһҒеҸҚеә”ејҸпјҡпјӣ
в‘ЎдёәдҪҝз”өи§Јдә§зү©е…ЁйғЁиҪ¬еҢ–дёәNH4NO3йңҖиЎҘе……зү©иҙЁгҖӮ

 D . еҪ“й“ңзүҮзҡ„иҙЁйҮҸеҸҳеҢ–дёә25.6 gж—¶пјҢaжһҒдёҠж¶ҲиҖ—зҡ„O2еңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„дҪ“з§Ҝдёә4.48 L
D . еҪ“й“ңзүҮзҡ„иҙЁйҮҸеҸҳеҢ–дёә25.6 gж—¶пјҢaжһҒдёҠж¶ҲиҖ—зҡ„O2еңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„дҪ“з§Ҝдёә4.48 L
-
пјҲ1пјү е·ІзҹҘпјҡ



еҶҷеҮәCдёҺ
 еҸҚеә”з”ҹжҲҗ
еҸҚеә”з”ҹжҲҗ зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸгҖӮ
зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸгҖӮ -
пјҲ2пјү е·ІзҹҘпјҡ4CO(g)+2NO2(g)вҮҢ4CO2(g)+N2(g)вҲҶH=-1200kJ/molгҖӮеңЁ
 жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢжҠ•е…Ҙ
жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢжҠ•е…Ҙ е’Ң
е’Ң пјҢ з»ҸиҝҮдёҖж®өж—¶й—ҙеҗҺиҫҫеҲ°е№іиЎЎзҠ¶жҖҒпјҢжөӢеҫ—
пјҢ з»ҸиҝҮдёҖж®өж—¶й—ҙеҗҺиҫҫеҲ°е№іиЎЎзҠ¶жҖҒпјҢжөӢеҫ— зҡ„иҪ¬еҢ–зҺҮдёә
зҡ„иҪ¬еҢ–зҺҮдёә гҖӮиҜҘжё©еәҰдёӢпјҢеҸҚеә”зҡ„е№іиЎЎеёёж•°дёәгҖӮ
гҖӮиҜҘжё©еәҰдёӢпјҢеҸҚеә”зҡ„е№іиЎЎеёёж•°дёәгҖӮ
-
пјҲ3пјү еҺҹз…Өз»Ҹзғӯи§ЈгҖҒеҶ·еҚҙеҫ—еҲ°зҡ„з…Өз„ҰеҸҜз”ЁдәҺ
 зҡ„и„ұйҷӨгҖӮзғӯи§Јжё©еәҰдёә
зҡ„и„ұйҷӨгҖӮзғӯи§Јжё©еәҰдёә еҫ—еҲ°зҡ„з…Өз„ҰеҲҶеҲ«з”Ё
еҫ—еҲ°зҡ„з…Өз„ҰеҲҶеҲ«з”Ё иЎЁзӨәпјҢзӣёе…ідҝЎжҒҜеҰӮдёӢиЎЁпјҡ
иЎЁзӨәпјҢзӣёе…ідҝЎжҒҜеҰӮдёӢиЎЁпјҡз…Өз„Ұ
е…ғзҙ еҲҶжһҗ/%
жҜ”иЎЁйқўз§Ҝ

C
H

80.79
2.76
105.69

84.26
0.82
8.98
е°ҶNOжө“еәҰжҒ’е®ҡзҡ„еәҹж°”д»Ҙеӣәе®ҡжөҒйҖҹйҖҡиҝҮеҸҚеә”еҷЁ(еӣҫ1)гҖӮдёҚеҗҢжё©еәҰдёӢпјҢиҝӣиЎҢеӨҡз»„е№іиЎҢе®һйӘҢпјҢжөӢе®ҡзӣёеҗҢж—¶й—ҙеҶ…NOзҡ„еҮәеҸЈжө“еәҰпјҢеҸҜеҫ—NOзҡ„и„ұйҷӨзҺҮдёҺжё©еәҰзҡ„е…ізі»еҰӮеӣҫ2жүҖзӨәгҖӮ
[е·ІзҹҘпјҡ
 зҡ„и„ұйҷӨдё»иҰҒеҢ…еҗ«еҗёйҷ„е’ҢеҢ–еӯҰиҝҳеҺҹ(
зҡ„и„ұйҷӨдё»иҰҒеҢ…еҗ«еҗёйҷ„е’ҢеҢ–еӯҰиҝҳеҺҹ(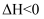 )дёӨдёӘиҝҮзЁӢ]
)дёӨдёӘиҝҮзЁӢ]
в‘ е·ІзҹҘз…Өз„ҰиЎЁйқўеӯҳеңЁзҡ„е®ҳиғҪеӣўжңүеҲ©дәҺеҗёйҷ„NOпјҢе…¶ж•°йҮҸдёҺз…Өз„Ұдёӯж°ўзўіиҙЁйҮҸжҜ”зҡ„еҖјеҜҶеҲҮзӣёе…іпјҢжҜ”еҖје°ҸпјҢиЎЁйқўе®ҳиғҪеӣўе°‘гҖӮз”ұеӣҫ2еҸҜзҹҘпјҢзӣёеҗҢжё©еәҰдёӢпјҢеҚ•дҪҚж—¶й—ҙеҶ…
 еҜ№NOзҡ„и„ұйҷӨзҺҮжҜ”
еҜ№NOзҡ„и„ұйҷӨзҺҮжҜ” зҡ„й«ҳпјҢеҸҜиғҪеҺҹеӣ жҳҜгҖӮ(зӯ”дёӨжқЎ)гҖӮ
зҡ„й«ҳпјҢеҸҜиғҪеҺҹеӣ жҳҜгҖӮ(зӯ”дёӨжқЎ)гҖӮв‘Ў
 еҗҺпјҢйҡҸзқҖжё©еәҰеҚҮй«ҳпјҢеҚ•дҪҚж—¶й—ҙеҶ…NOзҡ„и„ұйҷӨзҺҮеўһеӨ§зҡ„еҺҹеӣ жҳҜгҖӮ
еҗҺпјҢйҡҸзқҖжё©еәҰеҚҮй«ҳпјҢеҚ•дҪҚж—¶й—ҙеҶ…NOзҡ„и„ұйҷӨзҺҮеўһеӨ§зҡ„еҺҹеӣ жҳҜгҖӮ -
пјҲ4пјү з”өи§Јж°§еҢ–еҗёж”¶жі•пјҡе…¶еҺҹзҗҶеҰӮеӣҫ3жүҖзӨәпјҡ

в‘ д»ҺAеҸЈдёӯеҮәжқҘзҡ„зү©иҙЁзҡ„жҳҜгҖӮ
в‘ЎеҶҷеҮәз”өи§Јжұ йҳҙжһҒзҡ„з”өжһҒеҸҚеә”ејҸгҖӮ



