化学反应速率和化学平衡 知识点题库
-
(1) 用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=kJ·mol−1。
-
(2) 用稀硝酸吸收NOx , 得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:。
-
(3) 用酸性(NH2)2CO水溶液吸收NOx , 吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:。
-
(4) 在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见题20图−1)。
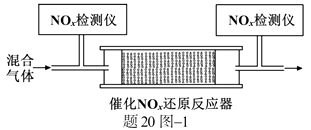
反应相同时间NOx的去除率随反应温度的变化曲线如题20图−2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是。

 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是 ( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是 ( )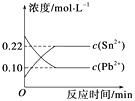
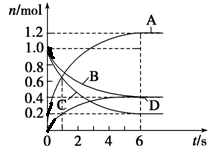
 6A+2C
B . 反应进行到1 s时,v(A)=v(D)
C . 反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D . 反应进行到6 s时,各物质的反应速率相等
6A+2C
B . 反应进行到1 s时,v(A)=v(D)
C . 反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D . 反应进行到6 s时,各物质的反应速率相等
C(s)+2NO(g)  CO2(g)+N2(g)△H
CO2(g)+N2(g)△H
-
(1) 实验方案中有下列措施:①采用加热提高反应速率,②使用催化剂提高反应速率,③使用加压提高NO转化率,④使CO2转化成干冰从体系用脱离,提高NO的转化率,你认为可行的是。
-
(2) 这个反应的平衡常数表达式是;
-
(3) 在恒容恒温密闭容器中,科学家得到下列实验数据
时间(min)
浓度(mol/L)
NO
N2
CO2
0
0.100
0
0
10
0.058
0.021
0.021
20
0.040
0.030
0.030
30
0.040
0.030
0.030
反应在该温度下的平衡常数K=;
-
(4) 若在(3)的实验中30min时开始升温,36min时达平衡,测得NO的转化率变为50%,则该反应的△H0(填“>”、“<”、“=”),判断的理由是;
-
(5) 若科学家在30min后改变了某一条件,反应进行到40min时达平衡浓度分别为c(NO)=0.032mol/L,c(N2)=0.034mol/L,c(CO2)=0.017mol/L,则改变的条件可能是,判断的依据是。

-
(1) 图中该反应是反应(填“吸热”或“放热”),反应热△H的表达式为
-
(2) 当反应达到平衡时,升高温度,A的转化率(填“增大”“减小”或“不变”)。
-
(3) 在反应体系中加入催化剂,E1和E2的变化是:E1,E2(填“增大’“减小”或“不变”),化学平衡移动(填“向左”、“向右”或“不”)。
 P(g)+2 L(?)。在不同的条件下P的体积分数φ(P)的变化情况如图,则该反应( )
P(g)+2 L(?)。在不同的条件下P的体积分数φ(P)的变化情况如图,则该反应( ) 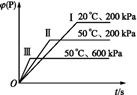
 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
-
(1) 用C 表示10s内反应的平均反应速率为。
-
(2) 反应前A的物质的量浓度是。
-
(3) 10s末,生成物D的浓度为。
-
(4) A 平衡转化率。
-
(1) 汽车尾气中常含有碳烟、CO、NO等有害物质,尾气中含有碳烟的主要原因为。
-
(2) 已知在298K和101kPa条件下,有如下反应:
反应①:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
反应②:N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ·mol-1
若反应
 CO2(g)+
CO2(g)+  N2(g)⇌
N2(g)⇌  C(s)+NO(g)的活化能为akJ·mol-1 , 则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为kJ·mol-1。
C(s)+NO(g)的活化能为akJ·mol-1 , 则反应C(s)+2NO(g)⇌CO2(g)+N2(g)的活化能为kJ·mol-1。 -
(3) 在常压下,已知反应2CO(g)+2NO(g)⇌N2(g)+2CO2(g) ΔH(298K)=-113.0kJ·mol-1 , ΔS(298K)=-145.3J/(mol·K),据此可判断该反应在常温下(填“能”或“不能”)自发进行。
-
(4) 向容积为2L的真空密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)⇌N2(g)+CO2(g),NO和N2的物质的量变化如表所示,在T1℃、T2℃分别到达平衡时容器的总压强分别为p1kPa、p2kPa。
物质的量/mol
T1℃
T2℃
0
5min
10min
15min
20min
25min
30min
NO
2.0
1.16
0.80
0.80
0.50
0.40
0.40
N2
0
0.42
0.60
0.60
0.75
0.80
0.80
①0~10min内,以NO表示的该反应速率v(NO)=kPa·min-1。
②第15min后,温度调整到T2 , 数据变化如表所示,则p1p2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,再次达平衡时NO的体积百分含量为。
-
(5) 为探究温度及不同催化剂对反应2NO(g)+2CO(g)+⇌N2(g)+2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图所示:
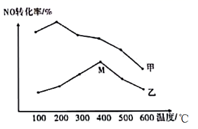
①在催化剂乙作用下,图中M点对应的速率(对应温度400℃)v正v逆(填“>”、“<”或“=”),其理由为。
②温度高于400℃,NO转化率降低的原因可能是。
-
(1) 现有容积为1L的恒温恒容密闭容器,向其中加入1molA气体和1molB气体后发生反应:A(g)+B(g)
 C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题: ①在题干条件下,说明该反应已经达到平衡状态的有(填序号)。
A.消耗0.1molA的同时生成0.1molC
B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化
D.A的转化率为50%
②保持容器温度和容积不变,若开始时向容器中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1、Q2与q的数值关系正确的是(填序号)。
A.Q1+Q2=q B.Q1+2Q2<q C.Q1+2Q2>q D.Q1+Q2<q
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入amolA气体,重新达平衡后,B气体的转化率为75%,则a=。
-
(2) 在一容积可变的密闭容器中充有10molCO和20molH2 , 发生CO(g)+2H2(g)
 CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。 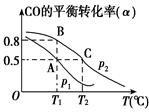
①A、B、C三点的平衡常数KA、KB、KC的大小关系为。
②若达到平衡状态A时,容器的体积为8L,则在平衡状态B时容器的体积为L。
-
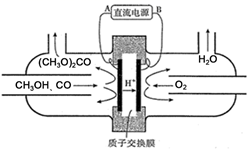
(3) 以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的正极为(填“A”或“B”),写出阳极的电极反应式。
 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。如,
反应I:2CO(g)+2NO(g)  N2(g)+2CO2(g) △H1;
N2(g)+2CO2(g) △H1;
反应II:4CO(g)+2NO2(g)  N2(g)+4CO2(g) △H2<0。
N2(g)+4CO2(g) △H2<0。
-
(1) 针对反应I:
①已知:反应N2(g)+O2(g)
 2NO(g) ΔH3=+180.0 kJ·mol-1 , 若CO的燃烧热为283.5 kJ·mol-1则反应I的△H1=kJ·mol−1。
2NO(g) ΔH3=+180.0 kJ·mol-1 , 若CO的燃烧热为283.5 kJ·mol-1则反应I的△H1=kJ·mol−1。②若在恒容的密闭容器中,充入2 mol CO和1 mol NO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.v(N2)正=2v(CO)逆
-
(2) 在2L密闭容器中充入2 mol CO和1 mol NO2 , 发生上述反应II。
①若在某温度下,该反应达平衡时CO的转化率为50%,则该反应的平衡常数为。

②图1为平衡时CO2的体积分数与温度、压强的关系。则温度:T1T2(填“<”或“>”);若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的点。
-
(3) 某研究小组探究催化剂对CO、NO2转化的影响。将NO2和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(脱氮率即NO2的转化率),结果如图2所示。
①若高于450℃,图2中曲线中脱氮率随温度升高而降低的主要原因是;
②a点(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由。
 2C(g)+2D(g),下列描述中不能说明该反应达到平衡状态的是( )
2C(g)+2D(g),下列描述中不能说明该反应达到平衡状态的是( )
 ]。
]。 下列说法正确的是( )
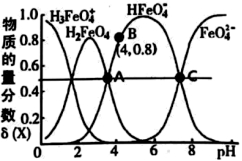
 H3FeO
H3FeO  (aq)的平衡常数K<100
D . K2FeO4起杀菌消毒作用是因为其遇水生成了Fe(OH)3胶体
(aq)的平衡常数K<100
D . K2FeO4起杀菌消毒作用是因为其遇水生成了Fe(OH)3胶体
 溶液中再加入
溶液中再加入  B .
B .  溶液加热
C . 氨水中加入少量
溶液加热
C . 氨水中加入少量  固体
D . 醋酸溶液加热
固体
D . 醋酸溶液加热
 。反应在初期阶段的速率方程为v=k∙c(CH4),其中k为反应速率常数。下列说法错误的是( )
。反应在初期阶段的速率方程为v=k∙c(CH4),其中k为反应速率常数。下列说法错误的是( )
主反应: 
副反应: 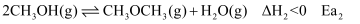
已知: 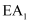 和
和  为正反应活化能,且
为正反应活化能,且 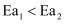 。
。
请回答:
-
(1) 有利于主反应平衡正向移动的适宜条件___________。A . 高温高压 B . 低温高压 C . 高温低压 D . 低温低压
-
(2) 反应:
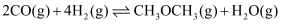 的
的  (用
(用 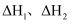 表示)
表示)
-
(3) 若主反应在恒温恒容下进行,下列说法正确的是___________A . 当容器压强不变,反应处于平衡状态 B . K值越大,反应速率一定越快 C .
 越小,放热越多,反应速率就越快
D . 使用合适催化剂,可快速提高反应平衡前的转化率
E . 正反应活化能越大,
越小,放热越多,反应速率就越快
D . 使用合适催化剂,可快速提高反应平衡前的转化率
E . 正反应活化能越大,  就越大
就越大
-
(4) 在
 时,
时, 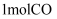 和
和 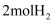 在体积为
在体积为 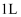 的恒温密闭容器中反应,测得2小时和5小时
的恒温密闭容器中反应,测得2小时和5小时  的选择性为80%和60%(
的选择性为80%和60%(  的选择性是指转化的
的选择性是指转化的  中生成
中生成  的百分比)。
的百分比)。  的转化率与时间的关系如图1所示:(不考虑其它副反应)
的转化率与时间的关系如图1所示:(不考虑其它副反应) 则:①2小时
 的产率。
的产率。②副反应的平衡常数。
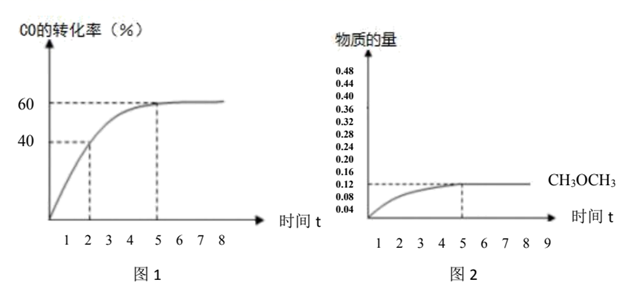
-
(5)
 的物质的量随时间变化如图2所示,请在图2上画出
的物质的量随时间变化如图2所示,请在图2上画出  的物质的量随时间变化曲线。
的物质的量随时间变化曲线。
 2NO2(g),容器中n(NO)随时间的变化如表所示:
2NO2(g),容器中n(NO)随时间的变化如表所示:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
-
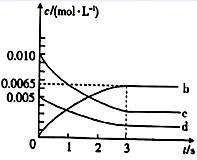
(1) 反应在1~2 s内,O2的物质的量减少mol。该反应在第秒时达到平衡状态。
-
(2) 如图所示,表示NO2浓度变化曲线的是(填字母)。用O2表示0~2 s内该反应的平均速率v=mol·L-1·s-1
-
(3) 能说明该反应已达到平衡状态的是(填字母)。
a.容器内气体颜色不再变化
b.O2的物质的量保持不变
c.容器内混合气体的密度保持不变


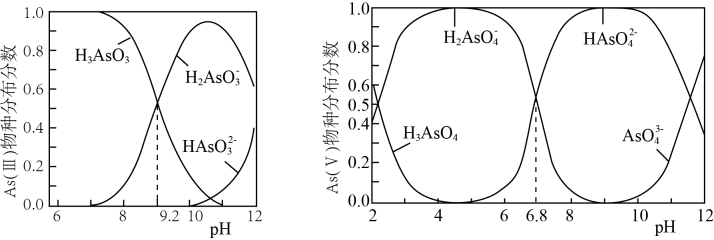
 +ClO-+OH-=HAsO
+ClO-+OH-=HAsO +Cl-+H2O
C . H2AsO
+Cl-+H2O
C . H2AsO +H2AsO
+H2AsO
 HAsO
HAsO +H3AsO3K=102.4
D . 相同温度下,同浓度的Na3AsO4溶液与Na2HAsO3溶液,前者碱性强
+H3AsO3K=102.4
D . 相同温度下,同浓度的Na3AsO4溶液与Na2HAsO3溶液,前者碱性强



