催化剂 知识点题库

已知:0<a<2。下列说法错误的是( )
-
(1) 新的研究表明,可以将 CO2 转化为炭黑回收利用,反应原理如图所示。

①整个过程中 FeO 的作用是;
②写出 CO2 转化为炭黑的总反应化学方程式。
-
(2) 由CO2 合成甲醇是CO2资源化利用的重要方法。
研究表明在催化剂作用下CO2 和H2可发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH
CH3OH(g) + H2O(g) ΔH ①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比n(CO2 )/ n(H2)
②研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如下图所示。ΔH0(填“>”或“<”),其依据是。

-
(3) 工业用二氧化碳加氢可合成乙醇:
 保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比
保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比  的关系如图所示。
的关系如图所示。 
①该反应平衡常数的表达式为。
②投料比m1、m2、m3由大到小的顺序为 。
-
(1) 根据如图提供的信息,写出该反应的热化学方程式,下图的曲线中(填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。

-
(2) 在恒容容器中,下列描述中能说明上述反应已达平衡的是。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
-
(3) 500℃、50MPa时,在容积为1 L的容器中加入1 mol N2、3 mol H2 , 反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K=。
-
(4) 为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号
T(℃)
n (N2)/n(H2)
P(MPa)
ⅰ
450
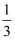
1
ⅱ
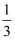
10
ⅲ
480
10
-
(5) 1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式为。


下列叙述正确的是( )


 2H2O+O2↑
D . H2O分子VSEPR模型为四面体
2H2O+O2↑
D . H2O分子VSEPR模型为四面体


 基催化剂表面,
基催化剂表面,  还原合成
还原合成  有以下两种途径,如图所示。下列说法错误的是( )
有以下两种途径,如图所示。下列说法错误的是( ) 
 分子仅断裂
分子仅断裂  键
B . 途径Ⅱ中
键
B . 途径Ⅱ中  分子中仅有一个N原子生成
分子中仅有一个N原子生成  ,另一N原子不参与反应
C . 两种途径的总反应式均
,另一N原子不参与反应
C . 两种途径的总反应式均  D . 使用
D . 使用  基催化剂可以降低反应的活化能,从而提高化学反应速率
基催化剂可以降低反应的活化能,从而提高化学反应速率

| 实验 | 实验现象 | 结论 |
| A. | 左侧试管比右侧试管中产生气泡的速率快 | Fe3+对H2O2分解的催化效果更好 |
| B. | 左侧棉花变为橙色,右侧棉花变为蓝色 | 氧化性:Cl2>Br2> I2 |
| C. | U形管左端液面下降,右端液面上升 | NH4NO3溶解吸热 |
| D. | 烧杯中产生白色沉淀 | 甲烷与氯气光照条件下发生取代反应 |

 2SO3中各成分的物质的量浓度变化,t2时刻改变的条件是缩小容器的体积
C . 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的CH3COOH溶液和一元酸HX溶液,则该温度下HX的电离平衡常数大于CH3COOH
D . 图丁表示用0.1000mol·L-1HCl溶液滴定0.1000mol·L-1NaOH溶液
2SO3中各成分的物质的量浓度变化,t2时刻改变的条件是缩小容器的体积
C . 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的CH3COOH溶液和一元酸HX溶液,则该温度下HX的电离平衡常数大于CH3COOH
D . 图丁表示用0.1000mol·L-1HCl溶液滴定0.1000mol·L-1NaOH溶液
 转化为NO的过程如图所示。下列说法正确的是( )
转化为NO的过程如图所示。下列说法正确的是( ) 
 )
B . 在催化剂b作用下,氮元素发生了还原反应
C . 催化剂a、b不会改变反应的焓变(
)
B . 在催化剂b作用下,氮元素发生了还原反应
C . 催化剂a、b不会改变反应的焓变(  )
D . 催化剂b可提高
)
D . 催化剂b可提高  的平衡转化率
的平衡转化率
 分子在催化剂的作用下发生的一系列转化示意图:
分子在催化剂的作用下发生的一系列转化示意图: 
下列叙述正确的是( )
 ,降低温度将缩短反应达到平衡的时间
D . 催化剂
,降低温度将缩短反应达到平衡的时间
D . 催化剂  表面反应生成NO时有电子转移
表面反应生成NO时有电子转移
| 选项 | A | B | C | D |
| 装置图 | | | | |
| 现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
| 结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
 与
与  制备合成气(
制备合成气(  、
、  ),可能的反应历程如图所示:
),可能的反应历程如图所示: 
说明:①  为吸附性活性炭,
为吸附性活性炭, 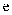 表示方框中物质的总能量(单位:
表示方框中物质的总能量(单位:  ),
), 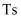 表示过渡态。
表示过渡态。
②相关化学键键能为: 


下列说法错误的是。( )
 可表示为
可表示为  B . 若
B . 若  ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为  C . 若
C . 若  ,
, 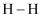 键能为
键能为  D . 使用催化剂后,
D . 使用催化剂后,  和
和  平衡产率不改变
平衡产率不改变
 和
和 转化为高附加值产品
转化为高附加值产品 的催化反应历程。该历程如图所示。下列说法错误的是( )
的催化反应历程。该历程如图所示。下列说法错误的是( )
 键
B .
键
B .  过程中有
过程中有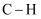 键断裂
C . 该反应总方程式为
键断裂
C . 该反应总方程式为 D . 反应中催化剂因有效降低反应物的能量而使得反应速率加快
D . 反应中催化剂因有效降低反应物的能量而使得反应速率加快
i.CH4(g)⇌C(s)+2H2(g) △H1=+75.0kJ/mol
ii.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=+41.0kJ/mol
iii.CO(g)+H2(g)⇌C(s)+H2O(g) △H3=-131.0kJ/mol
-
(1) 主反应的△H=kJ/mol。
-
(2) 我国学者对催化重整的主反应进行理论研究,提出在Pt—Ni或Sn—Ni合金催化下,先发生甲烷逐级脱氢反应,其反应历程如图所示(*表示吸附在催化剂表面)。

①该历程中最大能垒E(正)=eV/mol;
②其它条件相同时,催化重整的主反应在不同催化剂下反应相同时间,CO的产率随反应温度的变化如图所示:

B是合金催化下CO的产率随温度的变化曲线,A、B曲线到达W点后重合,请解释原因。
-
(3) 在恒容密闭容器中通入1molH2及一定量CO,反应ⅲ中CO的平衡转化率随n(CO)及温度变化如图。

①A、B两点对应的CO正反应速率v正(A)v正(B)(填“<”“=”或“>”,下同),B和C两点对应的反应温度TBTC。
②已知反应速率v正=k正x(CO)x(H2),v逆=k逆x(H2O),k为反应速率常数,x为气体的体积分数,在达到平衡状态为D点的反应过程(此过程为恒温)中,当某时刻CO的转化率刚好达到60%时,
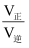 =。(用含k正和k逆的式子表示)
=。(用含k正和k逆的式子表示)
 2CH3OH(g)。
2CH3OH(g)。
已知:RlnKp=- +C(R、C均为常数)。
+C(R、C均为常数)。
下列说法错误的是( )











