催化剂 知识点题库
[实验化学]
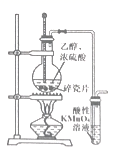
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。

-
(1) 实验装置中冷凝管的主要作用是 ,锥形瓶中的溶液应为 。
-
(2) 步骤1所加入的物质中,有一种物质是催化剂,其化学式为 。
-
(3) 步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的 (填化学式)。
-
(4) 步骤3中加入无水MgSO4固体的作用是 。
-
(5) 步骤4中采用减压蒸馏技术,是为了防止 。
 C2H4+2H2O、3CH3OH
C2H4+2H2O、3CH3OH  C3H6+3H2O,副反应为2CH3OH
C3H6+3H2O,副反应为2CH3OH  CH3OCH3+H2O。乙烯和丙烯的选择性(转化的甲醇中生成乙烯和丙烯的百分比)及丙烯对乙烯的比值(Cat.1和Cat.2代表两种等量的催化剂)如图所示,下列说法不正确的是( )。
CH3OCH3+H2O。乙烯和丙烯的选择性(转化的甲醇中生成乙烯和丙烯的百分比)及丙烯对乙烯的比值(Cat.1和Cat.2代表两种等量的催化剂)如图所示,下列说法不正确的是( )。 
 2SO42-(aq) + I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下:下列有关该反应的说法错误的是( )
2SO42-(aq) + I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下:下列有关该反应的说法错误的是( ) 
①2Fe3+ (aq) + 2I- (aq)  I2 (aq) + 2Fe2+ (aq)
I2 (aq) + 2Fe2+ (aq)
②2Fe2+ (aq) + S2O82- (aq)  2Fe3+ (aq) + 2SO42- (aq)
2Fe3+ (aq) + 2SO42- (aq)
 2SO42-(aq) + I2(aq)是放热反应
C . 加入Fe3+ 后降低了该反应的活化能
D . 向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深
2SO42-(aq) + I2(aq)是放热反应
C . 加入Fe3+ 后降低了该反应的活化能
D . 向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深

 代替氯气处理饮用水,可以杀菌消毒,还能沉降水中悬浮物
代替氯气处理饮用水,可以杀菌消毒,还能沉降水中悬浮物
已知:反应ICO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H1=-58kJ·mol-1
CH3OH(g)+H2O(g)△H1=-58kJ·mol-1
反应ICO2(g)+H2(g)  CO(g)+H2O(g)△H2=+41kJ·mol-1
CO(g)+H2O(g)△H2=+41kJ·mol-1
-
(1) CO(g)和H2(g)反应生成CH3OH(g)的热化学方程式为。
-
(2) 某实验过程中,控制压强一定,将CO2和H2按一定的初始投料比、一定流速通过催化剂,经过相同时间测得如下实验数据(反应未达到平衡状态):
T/K
CO2实际转化率/%
甲醇的选择性/%
543
12.3
42.3
553
15.3
39.1
表中实验数据表明,升高温度,CO2实际转化率提高而甲醇的选择性降低。其原因是。
-
(3) 在一定条件下,选择合适的催化剂只进行反应CO2(g)+H2(g)
 CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。
CO(g)+H2O(g)。调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图(各点对应的反应温度可能相同,也可能不同)。 
已知:Kx是以物质的量分数表示的化学平衡常数。
①经分析,A、E和G三点对应的反应温度相同,结合数据说明判断理由。
②已知反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。C、D、E三点中k正-k逆最大的是,A、B、F三点中v逆最大的是。计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到50%时,
 =。
=。 -
(4) 关于合成甲醇过程中用到的催化剂,下列说法错误的是___________(填字母)。A . 参与了反应,改变了反应历程和△H B . 使k正和k逆增大,但二者增大倍数不同 C . 降低了反应的活化能 D . 提高了CO2的平衡转化率

 (
(  储存还原)技术可有效降低柴油发动机中的
储存还原)技术可有效降低柴油发动机中的  排放,
排放,  的储存和还原在不同时段交替进行,工作原理如图所示。下列说法正确的是( )
的储存和还原在不同时段交替进行,工作原理如图所示。下列说法正确的是( ) 
 储存过程中N元素化合价不变
B .
储存过程中N元素化合价不变
B .  和
和  都是该反应过程的催化剂
C .
都是该反应过程的催化剂
C .  储存还原总反应中,
储存还原总反应中,  是还原剂,
是还原剂,  是还原产物
D .
是还原产物
D .  还原过程发生的反应为:
还原过程发生的反应为: 
| A | B | C | D |
| | | | |
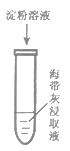
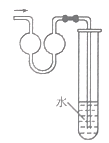
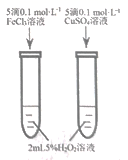
| 检验海带中有碘元素 | 吸收少量氨气 | 制备乙烯并验证其易被氧化 | 对比Fe2+、Cu2+对H2O2分解的催化效果 |
 2NOBr(g) △H =-a kJ·mol-1(a>0),其反应机理如下:
2NOBr(g) △H =-a kJ·mol-1(a>0),其反应机理如下: ①NO(g)+Br2(g)  NOBr2 (g) 快
NOBr2 (g) 快
②NO(g)+NOBr2(g)  2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
已知:①CH4(g)+2O2(g)  CO2(g)+2H2O(g)ΔH1=-802.0kJ·mol-1
CO2(g)+2H2O(g)ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g)  CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g)  2CO2(g)ΔH3=-566.0kJ·mol-1
2CO2(g)ΔH3=-566.0kJ·mol-1
下列有关说法正确的是( )

 在反应中起到催化剂的作用
C . 根据整个过程的总反应,理论上生成1molCH3CHO,电子转移为4mol
D . 若原料是丙烯,则产物可能是丙醛和丙酮
在反应中起到催化剂的作用
C . 根据整个过程的总反应,理论上生成1molCH3CHO,电子转移为4mol
D . 若原料是丙烯,则产物可能是丙醛和丙酮
 需要吸收1760kJ能量
B . 步骤②、③反应均为放热反应
C . 催化剂使用一段时间后失活的原因可能是碳在催化剂表面沉积
D . 使用该催化剂,反应的焓变不变
需要吸收1760kJ能量
B . 步骤②、③反应均为放热反应
C . 催化剂使用一段时间后失活的原因可能是碳在催化剂表面沉积
D . 使用该催化剂,反应的焓变不变
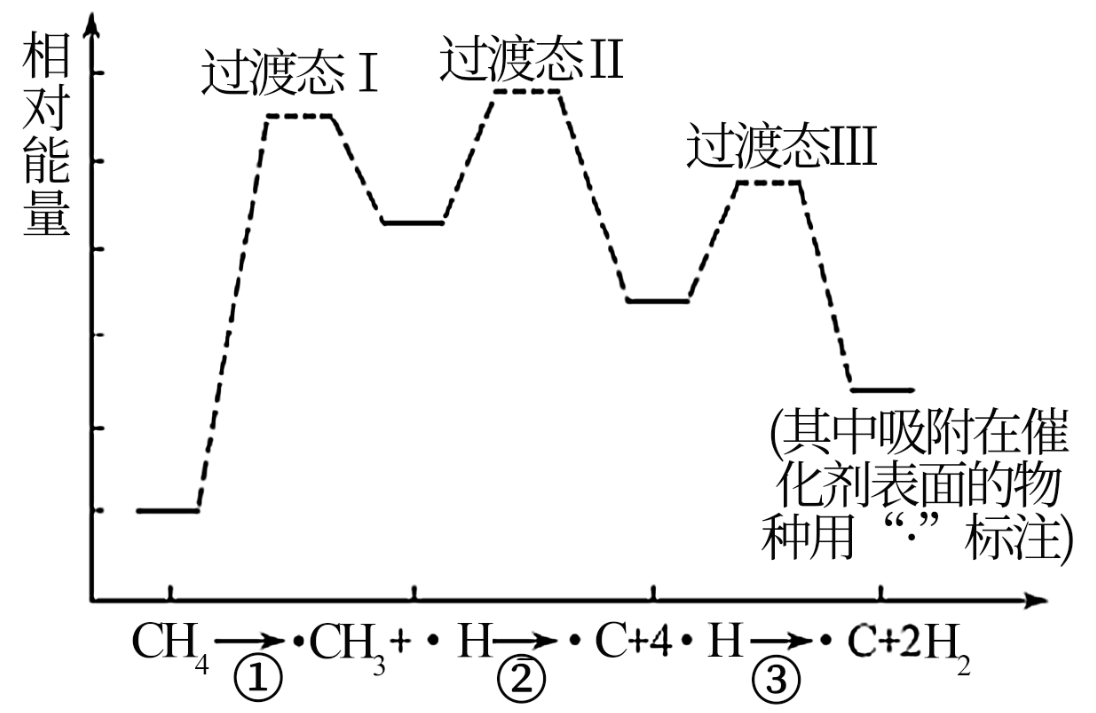
 和
和  分子在催化剂表面的部分变化过程如图所示。下列说法错误的是( )
分子在催化剂表面的部分变化过程如图所示。下列说法错误的是( ) 
 、
、  等中间产物
等中间产物

-
(1) 已知有关反应热化学方程式如下:
①C2H6(g)
 C2H4(g)+H2(g) △H1=+137kJ·mol-1
C2H4(g)+H2(g) △H1=+137kJ·mol-1②C2H4(g)+3O2(g)
 2CO2(g)+2H2O(l) △H2=-1411kJ·mol-1
2CO2(g)+2H2O(l) △H2=-1411kJ·mol-1欲利用反应①、②中的数据求C2H6(g)的燃烧热,还需要知道一种物质的燃烧热(用△H3表示),请写出该物质的燃烧热的热化学方程式。C2H6(g)的燃烧热(△H4)为(用含△H3的代数式表示)。
-
(2) 一定条件下向某刚性恒容密闭容器内充入一定量的C2H6(g),使其只发生反应①,测得不同温度,分别使用甲、乙两种催化剂的情况下,经过相同反应时间时乙烷的转化率随温度的变化情况如图1所示。

①温度低于1000K时,两种催化剂对该反应活化能影响较大的是(填“甲”或“乙”),使用该催化剂时,该转化反应适宜的温度是;使用催化剂甲时,当温度高于1000K时,C2H6的转化率减小的原因可能是(填标号)。
A.平衡向左移动
B.催化剂催化活性降低,导致反应速率减小
C.温度过高,乙烯与氢气发生反应
②乙烷的转化率随时间的变化关系如图2所示,在m点条件下,平衡时总压为2.1×105Pa,经过10min反应达到平衡状态,则0~10min内m点对应反应的v(C2H6)=Pa·min-1 , Kp为用气体分压表示的平衡常数,分压=总压×物质的量分数,则平衡常数Kp=Pa。

-
(3) 利用电解法可将乙烷转化为乙酸、乙烯等多种产品,工作原理如图3所示。写出生成乙酸的电极反应式:。


下列关于活化历程的说法正确的是( )