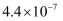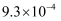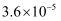电离平衡常数 知识点
电离平衡常数 知识点题库
 用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为
用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为  及少量的FeO、
及少量的FeO、  和
和  )为原料制备马日夫盐的主要工艺流程如图:
)为原料制备马日夫盐的主要工艺流程如图: 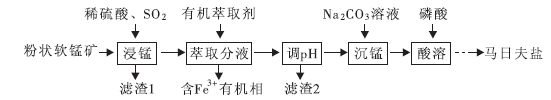
-
(1) “浸锰”过程中,FeO参与氧化还原反应的离子方程式为。
-
(2)
 的萃取率与溶液的pH的关系如图所示,当
的萃取率与溶液的pH的关系如图所示,当 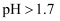 时,
时,  的萃取率急剧下降的原因可能为(用化学用语表示)。
的萃取率急剧下降的原因可能为(用化学用语表示)。 
-
(3) “调pH”的最大范围为。
金属离子
开始沉淀的pH
完全沉淀的pH

l. 8
3.2

3.0
5.0

5.8
8.8

7.8
9.8
-
(4) 如图为硫酸锰水合物的溶解度曲线,若要用“调pH”所得滤液制备
 ,需要控制温度在80℃~90℃之间的原因是,采用水浴加热,经蒸发浓缩、(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。
,需要控制温度在80℃~90℃之间的原因是,采用水浴加热,经蒸发浓缩、(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。 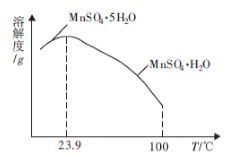
-
(5) 写出检验“沉锰”是否已完成的实验操作。
-
(6) 常温下,马日夫盐溶液显性(填“酸”或“碱”),理由是:。(写出计算过程并结合必要的文字说明。已知:
 的电离常数
的电离常数 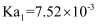 ,
, 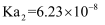 ,
, 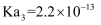 )
)
-
(1) Ⅰ.理论上稀的强酸、强碱反应生成1mol H2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 。
-
(2) 已知:乙苯催化脱氢制苯乙烯反应:苯在计算键能时,此处可看作为
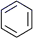 ,
, 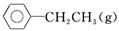
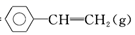 +H2(g)
+H2(g) 化学键
C—H
C—C
C=C
H—H
键能/kJ·mol-1
412
348
612
436
计算上述反应的ΔH= kJ·mol-1。
-
(3) Ⅱ.25 ℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.7×10-5
K1=4.3×10-7 K2=5.6×10-11
3.0×10-8
CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为。
-
(4) 将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:。
| 弱酸 | 氢氟酸 | 硼酸[B(OH)3](一元酸) | 草酸(H2C2O4) |
| 电离平衡常数(25℃) | 6.6×10-4 | 5.8×10-10 | K1=5.9×10-2 K2=6.4×10-5 |
则下列有关说法错误的是( )
| 弱酸(或弱碱)化学式 | CH3COOH | NH3·H2O | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10–5 | 1.8×10–5 | K1=4.3×10–7 K2=5.6×10–11 |
在25℃时,下列有关电解质溶液的说法错误的是( )
|
化学式 |
CH3COOH |
H2CO3 |
HClO |
|
电离平衡常数 |
1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
回答下列问题:
-
(1) 物质的量浓度为0.1mol/L的下列四种物质的溶液,pH由大到小的顺序是 (填编号)。
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
-
(2) 常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___。A . c(H+) B .
 C . c(H+)·c(OH-)
D .
C . c(H+)·c(OH-)
D . 
-
(3) 电离平衡常数是用实验的方法测定出来的,现已经测得25℃时cmol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=。(用含“c、a的代数式表示”)
 、NH3·H2O、HCO
、NH3·H2O、HCO  、CO
、CO  的分布如图(忽略溶液体积的变化)。已知常温下Kb(NH3·H2O)=1.8×10−5 , Ka1(H2CO3)=4.2×10−7 , Ka2(H2CO3)=5.6×10−11 , 则下列说法正确的是( )
的分布如图(忽略溶液体积的变化)。已知常温下Kb(NH3·H2O)=1.8×10−5 , Ka1(H2CO3)=4.2×10−7 , Ka2(H2CO3)=5.6×10−11 , 则下列说法正确的是( ) 
 )
C . n点时,溶液中3c(HCO
)
C . n点时,溶液中3c(HCO  )+c(OH⁻)=c(NH
)+c(OH⁻)=c(NH  )+c(H+)
D . 反应HCO
)+c(H+)
D . 反应HCO  +OH—
+OH—  CO
CO 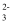 +H2O的平衡常数K=
+H2O的平衡常数K= 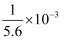
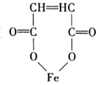 )是一种治疗贫血的药物,该药物与各种营养物质、抗生素的相容性好,具有协同作用。实验室利用糠醛(
)是一种治疗贫血的药物,该药物与各种营养物质、抗生素的相容性好,具有协同作用。实验室利用糠醛( 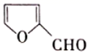 )和部分无机物可制备富马酸亚铁,制备的简易流程、实验装置如下:
)和部分无机物可制备富马酸亚铁,制备的简易流程、实验装置如下:
糠醛 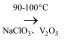
 富马酸晶体
富马酸晶体 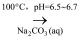

 粗产品
粗产品
已知:①部分物质的性质如下:
|
物质 |
颜色、状态(常温) |
熔点/℃ |
沸点/℃ |
溶解性 |
|
糠醛 |
无色油状液体 |
-36 |
162 |
可溶( |
|
富马酸 |
无色晶体 |
299 |
355.5 |
微溶于冷水,易溶于热水 |
|
富马酸亚铁 |
红棕色粉末 |
>280 |
微溶于冷水,易溶于热水 |
②常温下,碳酸和富马酸的电离常数如下:
|
|
|
|
|
碳酸 |
|
|
|
富马酸 |
|
|
回答下列问题:
-
(1) 仪器A的名称是,作为冷凝回流装置,仪器A相比仪器B的优点是。
-
(2) 图1中
 的作用是。
的作用是。
-
(3) 图2中通入氮气的目的是。
-
(4) 将富马酸晶体加入到热的纯碱溶液中发生反应的离子方程式是。
-
(5) 称取制备的粗产品
 ,溶解在加热煮沸且冷却的稀硫酸(
,溶解在加热煮沸且冷却的稀硫酸(  )中,然后用煮沸过的蒸馏水配成
)中,然后用煮沸过的蒸馏水配成 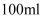 溶液,每次取
溶液,每次取  ,加入指示剂,马上用
,加入指示剂,马上用 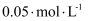 的
的  标准液滴定(
标准液滴定( 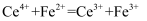 ),三次滴定消耗的标准液的体积平均值为
),三次滴定消耗的标准液的体积平均值为 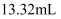 。
。
①用稀硫酸溶解富马酸亚铁的目的是。
②假设杂质不参与上述反应,粗产品的纯度为%(保留4位有效数字)。
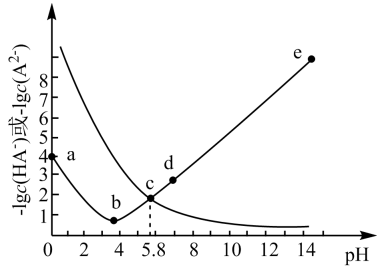
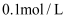 的
的  溶液体系中,含A粒子的分布系数
溶液体系中,含A粒子的分布系数  平衡时某粒子的浓度占各粒子浓度之和的分数
平衡时某粒子的浓度占各粒子浓度之和的分数  与溶液pH的关系如图所示.下列说法错误的是( )
与溶液pH的关系如图所示.下列说法错误的是( ) 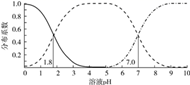
 的电离常数
的电离常数 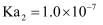 B . 室温下,
B . 室温下, 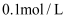 的NaHA溶液显酸性
C . 室温下,
的NaHA溶液显酸性
C . 室温下,  的
的  与
与 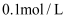 的NaOH溶液等体积混合,溶液
的NaOH溶液等体积混合,溶液 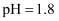 D .
D . 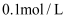 的
的  溶液中
溶液中 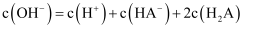
| 酸 | 电离常数(常温下) |
| CH3COOH | Ka=1.8×10-5 |
| H2CO3 | Ka1=4.3×10-7 , Ka2=5.6×10-11 |
| H2S | Ka1=9.1×10-8 , Ka2=1.1×10-12 |
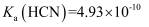 、
、 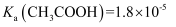 、
、 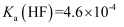 、
、  ,则常温下,等
,则常温下,等  的
的 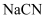 、
、 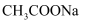 、
、 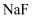 、
、  的浓度从大到小的顺序为( )
的浓度从大到小的顺序为( )
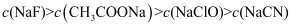 B .
B . 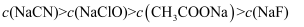 C .
C .  D .
D . 
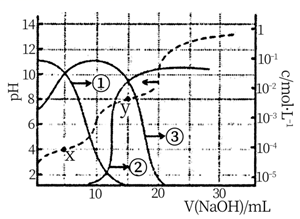
 、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入盐酸体积的变化曲线如图所示,d点两种溶液恰好完全反应。
、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入盐酸体积的变化曲线如图所示,d点两种溶液恰好完全反应。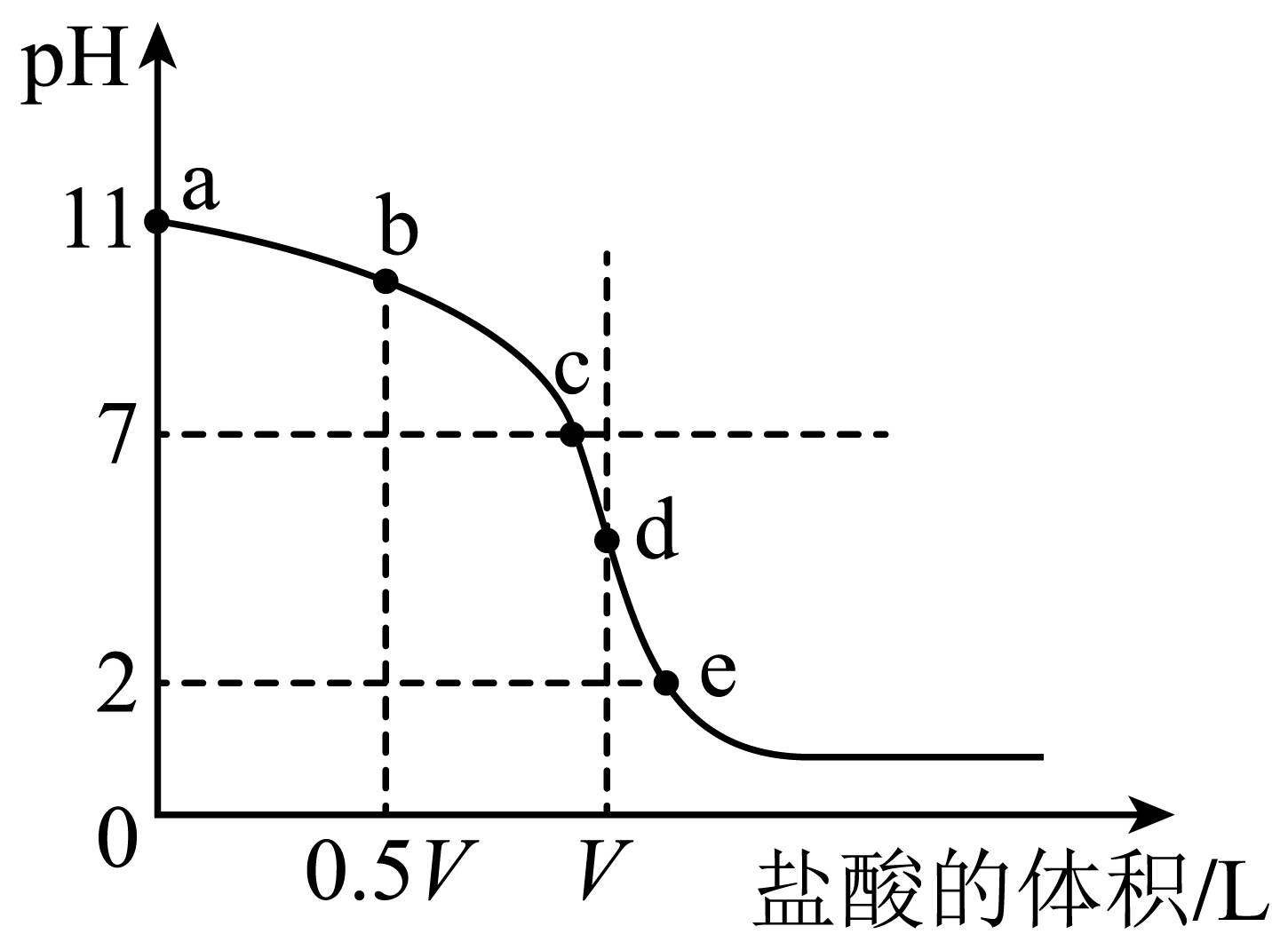
下列说法正确的是( )
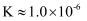 B . 由水电离出的
B . 由水电离出的 由大到小顺序:
由大到小顺序: C . 由b点到c点的过程中,
C . 由b点到c点的过程中, 、
、 的值均增大
D . 滴定过程中可能有
的值均增大
D . 滴定过程中可能有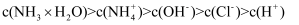
 时
时 的
的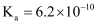 , 下列说法正确的是( )
, 下列说法正确的是( )
 溶液样品的
溶液样品的 发现前者小于后者,可推测
发现前者小于后者,可推测 的
的 B .
B .  的
的 溶液中加入
溶液中加入 的
的 溶液,当溶液中水的电离程度与纯水相同时,
溶液,当溶液中水的电离程度与纯水相同时,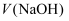 可能大于
可能大于 C . 向
C . 向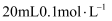 的
的 溶液中加入
溶液中加入 的
的 溶液充分反应,所得溶液中
溶液充分反应,所得溶液中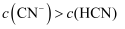 D . 将
D . 将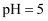 的
的 溶液与
溶液与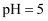 的盐酸混合,
的盐酸混合, 的电离度增大
的电离度增大
-
(1) 25℃时向浓度均为0.1mol/L的
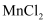 和
和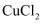 混合溶液中逐滴加入氨水,首先生成沉淀的离子方程式为。已知
混合溶液中逐滴加入氨水,首先生成沉淀的离子方程式为。已知 ,
,  。当两种沉淀共存时,
。当两种沉淀共存时,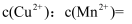 。
。
-
(2) 25℃时,
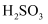 电离常数
电离常数 ,
,  , 则该温度下
, 则该温度下 的水解平衡常数Kh=mol/L(水解平衡常数Kh的书写规则同化学平衡常数)。
的水解平衡常数Kh=mol/L(水解平衡常数Kh的书写规则同化学平衡常数)。
-
(3) 在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中
 , 则溶液显性(填“酸”或“碱”或“中”);用含a的代数式表示
, 则溶液显性(填“酸”或“碱”或“中”);用含a的代数式表示 的电离常数Kb=。
的电离常数Kb=。
-
(4) 25℃时向含有
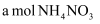 的溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为mol/L。(
的溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为mol/L。( 的电离平衡常数取
的电离平衡常数取 )
)
-
(5) 向废水中加入硫化物可以依次获得CuS、ZnS纳米粒子。常温下,
 的
的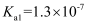 ,
, 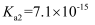 , 溶液中平衡时相关离子浓度的关系如图,下列说法正确的是。
, 溶液中平衡时相关离子浓度的关系如图,下列说法正确的是。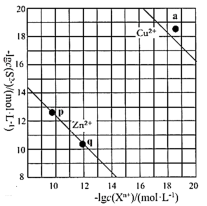
a.
 的数量级为
的数量级为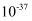
b. a点对应的CuS溶液为不饱和溶液
c.
 平衡常数很大,反应趋于完全
平衡常数很大,反应趋于完全d. 向p点的溶液中加入少量
 固体,溶液组成由p向q方向移动
固体,溶液组成由p向q方向移动
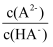 = 104.2
= 104.2
 )>c(OH-)>c(Cl-)>c(H+)
C . c点溶液中c(NH
)>c(OH-)>c(Cl-)>c(H+)
C . c点溶液中c(NH )<c(Cl-)
D . d点代表溶液呈中性
)<c(Cl-)
D . d点代表溶液呈中性
 水)
水)