电离平衡常数 知识点题库
| 弱电解质 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
 >CN->HCO
>CN->HCO  >HCOO-
B . 可发生2CN-+ H2O +CO2 = 2HCN + CO
>HCOO-
B . 可发生2CN-+ H2O +CO2 = 2HCN + CO  C . 等浓度NaCN和NaHCO3溶液中:c(Na+)>c(HCO
C . 等浓度NaCN和NaHCO3溶液中:c(Na+)>c(HCO  )>c(CN-)>c(OH-)>c(H+)
D . 相同浓度HCOOH和HCN溶液,HCOOH的pH更小
)>c(CN-)>c(OH-)>c(H+)
D . 相同浓度HCOOH和HCN溶液,HCOOH的pH更小
-
(1) 纯水在T℃时,pH=6,该温度下1mol/L的NaOH溶液中,由水电离出的c(OH-)=mol/L。
-
(2) 常温下,将1mlpH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液中pH为,稀释后溶液中
 =。
=。
-
(3) 某温度下,测得0.01mol/L的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=。
-
(4) pH相等的盐酸和醋酸溶液各100mL,分别与过量的Zn反应,相同条件下生成H2的体积分别为V1和V2 , 则V1V2(填“>”“<”或“=”)。
25℃,两种酸的电离平衡常数如下表
Ka1
Ka2
H2SO3
1.3×10-2
6.3×10-8
H2CO3
4.2×10-7
5.6×10-11
①写出二元弱酸H2CO3的第二步电离平衡常数表达式:。
②NaHSO3溶液和NaHCO3溶液反应的主要离子方程式为。

已知:H2NCH2CH2NH2+H2O⇌[H2NCH2CH2NH3]++OH-
下列说法正确的是( )
 或
或  ]随pH的变化如图。下列说法中错误的是( )
]随pH的变化如图。下列说法中错误的是( ) 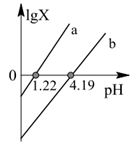
 )+2c(
)+2c(  )
D . 1.22<pH<4.19时,c(
)
D . 1.22<pH<4.19时,c(  )>c(
)>c(  )>c(H2C2O4)
)>c(H2C2O4)
 ,
, 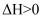 ,700℃时平衡常数为1.47。下列说法正确的是( )
,700℃时平衡常数为1.47。下列说法正确的是( )

-
(1) 已知某温度时,醋酸的电离平衡常数
 。醋酸的起始浓度为0.010mol/L,平衡时
。醋酸的起始浓度为0.010mol/L,平衡时  mol/L(提示:醋酸的电离平衡常数很小,平衡时的
mol/L(提示:醋酸的电离平衡常数很小,平衡时的  可近似为0.010mol/L)。
可近似为0.010mol/L)。
-
(2) 常温下,等浓度NaOH(aq)和
 (aq)按1:2体积比混合后pH<7,离子浓度大小关系为。
(aq)按1:2体积比混合后pH<7,离子浓度大小关系为。
-
(3) 日常生活中常用醋酸除水垢,但工业锅炉的水垢中常含有
 ,需先用(填化学式)溶液处理,而后用盐酸去除。
,需先用(填化学式)溶液处理,而后用盐酸去除。
-
(4) 炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会锈蚀,其锈蚀过程属于(填“析氢腐蚀”或“吸氧腐蚀”),正极的电极反应式为。
-
(1) 已知部分弱酸的电离常数如下表:

①写出H2S的Ka1的表达式:
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是。
-
(2) 室温下,用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①②填“>”“<”或“=”)

①a点所示的溶液中c(NH3·H2O)c(Cl-)。
②b点所示的溶液中c(Cl-)c(NH4+)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为。

-
(3) 二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=。
 。
。 时,用
时,用 的
的 溶液滴定
溶液滴定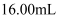 某未知浓度的
某未知浓度的 溶液,滴定过程中消耗
溶液,滴定过程中消耗 溶液的体积与混合溶液
溶液的体积与混合溶液 之间的关系如图所示(已知:
之间的关系如图所示(已知: , 酸性
, 酸性 )。
)。
下列说法错误的是( )
 电离常数的数量级为
电离常数的数量级为 B . b点溶液中存在
B . b点溶液中存在 C . c点溶液中离子浓度的大小关系为
C . c点溶液中离子浓度的大小关系为 D . 若将
D . 若将 改为等体积等浓度的
改为等体积等浓度的 , 则
, 则 随
随 溶液体积的变化曲线竖直上移
溶液体积的变化曲线竖直上移

 B . 当溶液的pH=9时,溶液中存在下列关系:
B . 当溶液的pH=9时,溶液中存在下列关系: C .
C .  反应的平衡常数为K,则
反应的平衡常数为K,则 D . 往该溶液中逐滴滴加氢氧化钠时
D . 往该溶液中逐滴滴加氢氧化钠时 和HCO
和HCO 浓度逐渐减小
浓度逐渐减小
 , 下列反应的离子方程式正确的是( )
, 下列反应的离子方程式正确的是( )
 的混合溶液中滴加3倍体积的等浓度的稀盐酸
的混合溶液中滴加3倍体积的等浓度的稀盐酸 B . 将少量的双氧水滴入酸性高锰酸钾溶液中:
B . 将少量的双氧水滴入酸性高锰酸钾溶液中: C . 将少量
C . 将少量 通入“84”消毒液中:
通入“84”消毒液中: D . 将少量氯气通入纯碱溶液中:
D . 将少量氯气通入纯碱溶液中:
 的沉淀溶解平衡曲线如图所示(
的沉淀溶解平衡曲线如图所示( )。则下列说法正确的是( )
)。则下列说法正确的是( )
 在b点对应的溶解度小于c点
B .
在b点对应的溶解度小于c点
B .  沉淀溶解是放热的过程
C .
沉淀溶解是放热的过程
C .  D .
D .  温度下,在
温度下,在 饱和溶液中加入
饱和溶液中加入 固体可使溶液由c点变到a点
固体可使溶液由c点变到a点
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
-
(1) 常温下,物质的量溶度相同的三种物质的量浓度①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是(填序号)。
-
(2) 25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为。
-
(3) NaClO溶液中的电荷守恒关系为。
-
(4) 向NaClO溶液中通入少量的CO2 , 所发生的离子方程式为。
-
(5) 25℃下,将
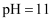 的苛性钠溶液
的苛性钠溶液 与
与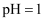 的稀硫酸
的稀硫酸 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的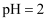 , 则
, 则 。
。
-
(6) 25℃时,H2SO3⇌H++HSO
 的电离常数
的电离常数 , 则该温度下
, 则该温度下 的水解常数Kh=。
的水解常数Kh=。
 H++OH- , 常温下,Kw 的数值为 1×10-14.下列说法错误的是( )
H++OH- , 常温下,Kw 的数值为 1×10-14.下列说法错误的是( )
 )、
)、 、
、 ]随pOH[pOH=-lgc(OH-)]的变化如图所示,下列说法错误的是( )
]随pOH[pOH=-lgc(OH-)]的变化如图所示,下列说法错误的是( )
 随pOH的变化关系
B . 2H2PO
随pOH的变化关系
B . 2H2PO
 H3PO4+HPO
H3PO4+HPO 的平衡常数的数量级约为10-7
C . 当溶液pH=7时,c(H2PO
的平衡常数的数量级约为10-7
C . 当溶液pH=7时,c(H2PO )>c(HPO
)>c(HPO )>c(PO
)>c(PO )
D . M点时,c(Na+)+c(H+)=c(H2PO
)
D . M点时,c(Na+)+c(H+)=c(H2PO )+5c(PO
)+5c(PO )+c(OH-)
)+c(OH-)

回答下列问题:
-
(1) “浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式。
-
(2) “氧化ⅰ”过程软锰矿的作用是。“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是(填标号)。
a.
 b.
b.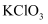 c.
c.
-
(3) 工业上煅烧硫铁矿产生的
 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得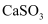 与水形成的浊液pH为9,若忽略
与水形成的浊液pH为9,若忽略 的第二步水解,则
的第二步水解,则 (保留三位有效数字)[已知:室温下亚硫酸
(保留三位有效数字)[已知:室温下亚硫酸 的电离平衡常数
的电离平衡常数 ,
,  ]
]
-
(4) “沉锰”过程
 转化为
转化为 的离子方程式为。在一定空气流速下,相同时间内“焙烧”
的离子方程式为。在一定空气流速下,相同时间内“焙烧” , 产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
, 产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①

②


③


为了增大产物中
 的占比,可以采用的措施是(答出两条)。将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为:
的占比,可以采用的措施是(答出两条)。将制备获得的电池级二氧化锰用于构建水系锌锰电池,其工作原理为: , 放电时正极的电极反应式为。
, 放电时正极的电极反应式为。 -
(5) 用氧化还原法测定
 纯品纯度(杂质不参与下列反应):称取
纯品纯度(杂质不参与下列反应):称取 样品0.1000g,试样经过过氧化钠碱熔后,得到
样品0.1000g,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 , 过滤除去
, 过滤除去 , 用
, 用 标准溶液滴定
标准溶液滴定 , 用去37.00mL,则样品中
, 用去37.00mL,则样品中 的质量分数为(保留3位有效数字)。
的质量分数为(保留3位有效数字)。
 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )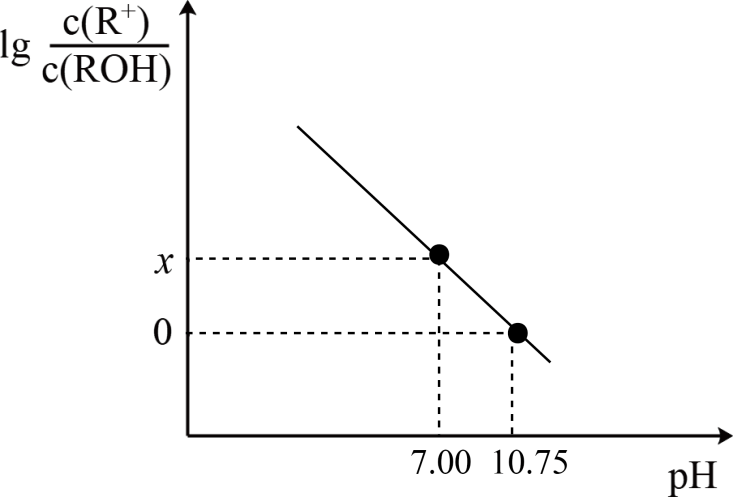

 )+2c(H+)
B . a、b、c三点对应
)+2c(H+)
B . a、b、c三点对应 的水解平衡常数:Kh(b)>Kh(a)>Kh(c)
C . 当溶液中pH=pOH时,水的电离程度最大
D . 稀H2SO4的物质的量浓度为0.05mol·L-1
的水解平衡常数:Kh(b)>Kh(a)>Kh(c)
C . 当溶液中pH=pOH时,水的电离程度最大
D . 稀H2SO4的物质的量浓度为0.05mol·L-1
弱电解质 |
|
|
|
电离平衡常数 |
|
|
|
-
(1) 写出
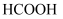 的
的 的表达式。
的表达式。
-
(2) 向等体积、等
 的草酸和甲酸溶液中加入大小相同的锌粒,初始速率分别是
的草酸和甲酸溶液中加入大小相同的锌粒,初始速率分别是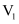 、
、 , 其大小关系为
, 其大小关系为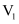
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
-
(3) 稀释
 溶液
溶液 (填“增大”“减小”或“不变”)。
(填“增大”“减小”或“不变”)。
-
(4)
 溶液显性(填“酸”“碱”或“中”)。
溶液显性(填“酸”“碱”或“中”)。
-
(5) 向
 溶液中滴加过量的甲酸溶液,反应的离子方程式为。
溶液中滴加过量的甲酸溶液,反应的离子方程式为。
 )、雄黄(
)、雄黄( )、砒霜(
)、砒霜( )、亚砷酸(
)、亚砷酸( )、砷酸(
)、砷酸( )等化合物,有着广泛的用途。回答下列问题:
)等化合物,有着广泛的用途。回答下列问题:
-
(1) 一定条件下,雌黄和雄黄的转化关系如图所示。

①应Ⅰ中的氧化剂是(填化学式)。
②反应Ⅱ中,若1 mol
 发生反应转移
发生反应转移 , 则反应Ⅱ的化学方程式为。
, 则反应Ⅱ的化学方程式为。 -
(2) 亚砷酸可用于治疗白血病,在溶液中存在多种微粒形态。向1L
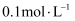
 溶液中逐滴加入KOH溶液,各种微粒的物质的量分数与溶液的pH关系如图所示。
溶液中逐滴加入KOH溶液,各种微粒的物质的量分数与溶液的pH关系如图所示。
①体血液的pH为7.35~7.45,用药后人体所含砷元素的主要微粒是
②
 第一步电离的电离常数为
第一步电离的电离常数为 , 则
, 则 (
( )。
)。③下列说法正确的是 (填标号)。
A.当
 时,溶液呈碱性
时,溶液呈碱性B.pH在8.0~10.0时,反应的离子方程式为:

C.M点对应的溶液中:

D.pH=12时,溶液中:

-
(3) 某工业废水中砷含量极高,为控制砷的排放,采用化学沉降法处理含砷废水:向废水中先加入适量漂白粉,再加入生石灰调节pH,将砷元素转化为
 沉淀。则要除去
沉淀。则要除去 , 溶液中的
, 溶液中的 至少为
至少为 。已知:{
。已知:{ , 当残留在溶液中的离子浓度
, 当残留在溶液中的离子浓度 时,可认为沉淀完全}。
时,可认为沉淀完全}。
 (草酸)
(草酸)






