离子积常数 知识点
离子积常数:是指水和电解质溶液中水的电离平衡和电解质溶液中氢离子的浓度和氢氧根离子的浓度之积是一个定值。常用KW来表示,只与温度有关。在25℃时,Kw=1.0×10-14。
离子积常数 知识点题库
此表是不同温度下水的离子积数据:试回答以下问题:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1.0×10﹣14 | α | 1.0×10﹣12 |
(1)若25<t1<t2 , 则α (填“<”“>”或“=”)1.0×10﹣14 , 作出此判断的理由是 .
(2)25℃下,某Na2SO4溶液中c(SO42﹣)=5×10﹣4mol•L﹣1 , 取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(OH﹣)= .
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2= .
下列有关说法正确的是 ( )
A . 标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.1NA
B . 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
C . 工业上需要把BaSO4沉淀转化为BaCO3 沉淀,然后获得Ba2+ , 这是因为Ksp(BaSO4)>Ksp(BaCO3),
D . 已知I  I2+I- , 向盛有KI3溶液的试管中加入适量CCl4 , 振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I- , 向盛有KI3溶液的试管中加入适量CCl4 , 振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
某温度(t℃)下的溶液中,c(H+)=10﹣xmol/L,c(OH﹣)=10﹣y mol/L,x与y的关系如图所示.
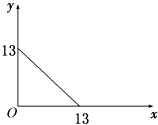
请回答下列问题:
-
(1) 此温度时,水的离子积Kw为,则该温度t25℃(填“>”“<”“=”).
-
(2) 若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小.
①若所得混合液为中性,此溶液中各种离子的浓度由大到小排列顺序是.
②若所得混合液的pH=2,则a:b=;此溶液中各种离子的浓度由大到小排列顺序是.
在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度最接近于( )
A . 1/2(10-9+10-11)mol/L
B . 2×10-11 mol/L
C . (10-9+10-11)mol/L
D . 1/2(10-5+10-3)mol/L
25℃时,水的电离达到平衡:H2O  H++OH- DH>0,下列叙述正确的是( )
H++OH- DH>0,下列叙述正确的是( )
 H++OH- DH>0,下列叙述正确的是( )
H++OH- DH>0,下列叙述正确的是( )
A . 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B . 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C . 将水加热,KW增大,pH不变
D . 向水中加入少量CH3COOH,平衡正向移动,c(H+)增大
将下列四种溶液适当升高到一定温度后,pH不发生变化的是( )
A . pH=1的H2SO4溶液
B . NaCl溶液
C . pH=3的NH4Cl溶液
D . pH=13的NaOH溶液
已知:pOH=-lgc(OH-),在常温下溶液中的pH+pOH=14,又已知正常人(人的体温高于室温)的血液pH=7.3,则正常人血液的pOH是( )
A . 大于6.7
B . 小于6.7
C . 等于6.7
D . 无法判断
常温下,最适宜薄荷生长的土壤pH≈8,土壤中的c(OH-)最接近于()
A . 1×10-5mol/L
B . 1×10-6 mol/L
C . 1×10-8 mol/L
D . 1×10-9mol/L
阿伏加德罗常数的值为NA。下列说法错误的是( )
A . 1LpH=3的盐酸与1LpH=3的CH3COOH溶液中,水电离出的H+数目均为10-3NA
B . 0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA
C . 标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA
D . 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数等于0.2mol
常温下向10mL0.1mol/L的HR溶液中逐渐滴入0.1mol/L的NH3·H2O溶液, 所得溶液pH及导电性变化如图。下列分析错误的是( )
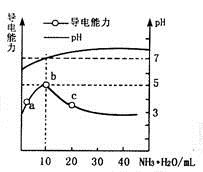
A . a~b点导电能力增强,说明HR为弱酸
B . b点溶液pH=7,说明NH4R没有水解
C . c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D . b~c任意点溶液均有c(H+)×c(OH-)=Kw=1.0×10-14
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 1molAlCl3在熔融状态时含有的离子总数为4NA
B . 某温度下纯水的pH=6,该温度下10LpH=11的NaOH溶液中含OH-的数目为NA
C . 8.7g二氧化锰与含有0.4molHCl的浓盐酸加热充分反应,转移电子的数目为0.2NA
D . 12g金刚石中C-C键的数目为4NA
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A . 常温下,0.1 mol·L一1的碳酸钠溶液中含有的阴离子数大于0.1NA
B . 标准状况下,33.6 mL氯气通入足量水中发生反应,转移电子数为1.5×10-3NA
C . 常温常压下,28 g由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA
D . 同温下,pH=1体积为1 L的硫酸溶液所含氢离子数与pH=13体积为1 L的氢氧化钠溶液所含氢氧根离子数均为0.1NA
某酸在水溶液中,四种微粒的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列说法正确的是( )
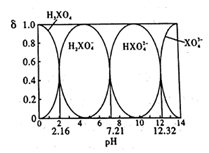
A . H3XO4为三元弱酸,NaH2XO4溶液呈碱性
B . -lgKa3=12.32
C . 向0.1 mol/L的Na3XO4溶液中滴加几滴浓KOH溶液,  的值变大
D . 0.1 mol/L的Na2HXO4溶液中,c(Na+)+c(H+)=c(XO43-)+c(HXO42-)+c(H2XO4-)+c(OH-)
的值变大
D . 0.1 mol/L的Na2HXO4溶液中,c(Na+)+c(H+)=c(XO43-)+c(HXO42-)+c(H2XO4-)+c(OH-)
 的值变大
D . 0.1 mol/L的Na2HXO4溶液中,c(Na+)+c(H+)=c(XO43-)+c(HXO42-)+c(H2XO4-)+c(OH-)
的值变大
D . 0.1 mol/L的Na2HXO4溶液中,c(Na+)+c(H+)=c(XO43-)+c(HXO42-)+c(H2XO4-)+c(OH-)
25℃时,在0.01mol/L的稀盐酸中,水电离出的 c(H+)是( )
A . 5×10-13mol/L
B . 0.02mol/L
C . 1×10-7mol/L
D . 1×10-12mol/L
已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述错误的是( )
A . 该温度高于25℃
B . 由水电离出来的H+的浓度为1×10-10 mol·L-1
C . 加入NaHSO4晶体抑制了水的电离
D . 取该溶液加水稀释100倍,溶液中的c(OH-)减小
室温下,某0.1mol/L的CH3COONa溶液的pH=11。
-
(1) 写出水解常数的表达式Kh=。
-
(2) 写出水解常数Kh与Ka、Kw之间的关系式。
-
(3) 计算CH3COONa水解百分数(水解度)。
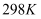 时,酸
时,酸 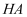 的电离平衡常数
的电离平衡常数 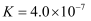 ,水的离子积
,水的离子积 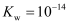 .试计算,在该温度下:
.试计算,在该温度下:
-
(1)
 的
的 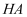 溶液中,由水电离产生的
溶液中,由水电离产生的  ;
;
-
(2)
 的
的 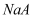 溶液中
溶液中 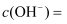
在其他条件不变的情况下,升高温度,下列数值不一定增大的是( )
①水解平衡常数 ②化学平衡常数 ③电离平衡常数 ④溶度积常数
A . ②④
B . ①④
C . ③④
D . ②③
设N A 为阿伏加德罗常数的值,下列有关叙述正确的是( )
A . 室温下pH =12的Na2CO3溶液中,由水电离出的OH-数目为0.01NA
B . 1.0 L1.0 mol/L的NaAlO2 溶液中含氧原子数为2NA
C . 0.2 mol SO 2与0.2 mol O2 在一定条件下充分反应生成SO3 分子数为0.2NA
D . 3.9gNa2O2 固体中含有阴阳离子的总数目为0.15NA
根据下列图示所得出的结论错误的是( )

A . 图甲是常温下用 的
的 溶液分别滴定
溶液分别滴定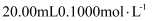 一元酸
一元酸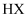 、
、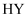 的滴定曲线,说明
的滴定曲线,说明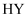 的酸性大于
的酸性大于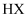 B . 图乙表示温度在
B . 图乙表示温度在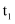 和
和 时水溶液中
时水溶液中 和
和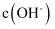 的关系,则阴影部分M内任意一点均满足
的关系,则阴影部分M内任意一点均满足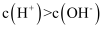 C . 图丙表示改变平衡体系
C . 图丙表示改变平衡体系 的某一条件后,v(正)、v(逆)的变化情况,可推知
的某一条件后,v(正)、v(逆)的变化情况,可推知 时刻改变的条件是升高温度
D . 图丁表示炭黑作用下
时刻改变的条件是升高温度
D . 图丁表示炭黑作用下 生成活化氧过程中能量变化情况,说明每活化一个氧分子放出
生成活化氧过程中能量变化情况,说明每活化一个氧分子放出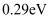 能量
能量
 的
的 溶液分别滴定
溶液分别滴定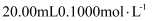 一元酸
一元酸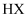 、
、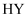 的滴定曲线,说明
的滴定曲线,说明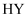 的酸性大于
的酸性大于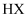 B . 图乙表示温度在
B . 图乙表示温度在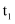 和
和 时水溶液中
时水溶液中 和
和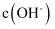 的关系,则阴影部分M内任意一点均满足
的关系,则阴影部分M内任意一点均满足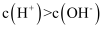 C . 图丙表示改变平衡体系
C . 图丙表示改变平衡体系 的某一条件后,v(正)、v(逆)的变化情况,可推知
的某一条件后,v(正)、v(逆)的变化情况,可推知 时刻改变的条件是升高温度
D . 图丁表示炭黑作用下
时刻改变的条件是升高温度
D . 图丁表示炭黑作用下 生成活化氧过程中能量变化情况,说明每活化一个氧分子放出
生成活化氧过程中能量变化情况,说明每活化一个氧分子放出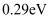 能量
能量
最近更新



