离子积常数 知识点题库
水的电离过程为H2O H++OH- , 在不同温度下其离子积为KW(25℃)=1.0×10-14 , KW(35℃)=2.1×10-14。则下列叙述正确的是( )
H++OH- , 在不同温度下其离子积为KW(25℃)=1.0×10-14 , KW(35℃)=2.1×10-14。则下列叙述正确的是( )
A . c(H+)随温度的升高而降低
B . 35℃时,c(H+)>c(OH-)
C . 溶液:pH(35℃)>pH(25℃)
D . 水的电离是吸热的过程
水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH﹣)=常数,下列说法错误的是( )

A . 图中温度T1>T2
B . 图中五点Kw间的关系:B>C>A=D=E
C . 曲线a、b均代表纯水的电离情况
D . 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
合成氨反应(N2+3H2⇌2NH3+92.4KJ)在化学工业和国防工业具有重要意义.工业合成氨生产示意图如图所示.

-
(1) X的化学式为;X的状态为态.
-
(2) 据图分析,下列说法正确的是(填写编号).
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
-
(3) 常温下氨气极易溶于水,其水溶液可以导电.
①氨水中水的离子积常数的数值是;
②将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为.
25℃时,在等体积的 ① pH=0的H2SO4溶液 ②0.05mol·L-1的Ba(OH)2溶液 ③pH=10的Na2S溶液 ④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A . 1∶10∶1010∶109
B . 1∶5∶5×109∶5×108
C . 1∶20∶1010∶109
D . 1∶10∶104∶109
一定温度下,用水稀释0.1mol/L的一元弱酸HA,随着稀释的进行,下列数值一定增大的是(  表示水的离子积,
表示水的离子积,  表示HA的电离常数)( )
表示HA的电离常数)( )
 表示水的离子积,
表示水的离子积,  表示HA的电离常数)( )
表示HA的电离常数)( )
A .  B .
B .  C .
C . 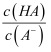 D . c(OH-)
D . c(OH-)
 B .
B .  C .
C . 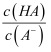 D . c(OH-)
D . c(OH-)
向蒸馏水中滴入少量盐酸后,下列说法中正确的是( )
A . c(H+)·c(OH-)不变
B . pH增大了
C . 水的电离程度增大了
D . 水电离出的c(H+)增加了
已知:pOH=-lgc(OH-),温度为T℃时,向20.00mL 0.01mol·L-1氨水中滴入0.10mol·L-1的盐酸(不考虑溶质挥发),溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是()

A . 曲线PJN表示溶液中pH的变化
B . 若M点水的电离程度与Q点相等,则Q点一定符合c(Cl-)>c(NH4+)+c(NH3·H2O)
C . M、P两点的数值之和a+b=14
D . pH与pOH交叉点J对应的V(盐酸)=20.00mL
浓度均为0.1mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随1g  的变化关系如图所示。下列叙述正确的是( )
的变化关系如图所示。下列叙述正确的是( )
 的变化关系如图所示。下列叙述正确的是( )
的变化关系如图所示。下列叙述正确的是( ) 
A . HX、HY都是弱酸,且HX的酸性比HY的弱
B . 相同温度下,电离常数K(HX)∶a>b
C . 常温下,由水电离出的c(H+)·c(OH-)∶a<b
D . 1g  =3,若同时微热两种溶液,则
=3,若同时微热两种溶液,则  减小
减小
 =3,若同时微热两种溶液,则
=3,若同时微热两种溶液,则  减小
减小
常温下,下列各组离子在指定溶液中能大量共存的是( )
A . c(H+)/c(0H-)=1012 的溶液中:NH4+、Al3+、NO3-、Cl-
B . pH=1 的溶液中:Fe2+、NO3-、SO42-、Na+
C . 由水电离的c(H+)=1×10-14mol·L-1 的溶液中:Ca2+、K+、Cl-、HCO3-
D . c(Fe3+)=0.1mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
在标准状况下,下列说法正确的是( )
A . 等体积CH4和HF所含的电子数相同
B . pH=12的Na2CO3溶液中c(OH-)=1×10-2 mol/L
C . 2.4 g Mg与足量的盐酸反应,放出的气体体积为2.24 L
D . 由H2O2制2.24 L O2转移的电子数目为0.4 NA
25 ℃时,水的电离达到平衡:H2O  H++ OH-;ΔH > 0 ,下列叙述正确的是( )
H++ OH-;ΔH > 0 ,下列叙述正确的是( )
 H++ OH-;ΔH > 0 ,下列叙述正确的是( )
H++ OH-;ΔH > 0 ,下列叙述正确的是( )
A . 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B . 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C . 向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D . 将水加热,Kw增大,pH不变
下列有关化学平衡常数K、电离平衡常数Ka、水的离子积常数Kw的说法中错误的是( )
A . 各常数的大小与温度有关
B . 各常数的大小说明平衡体系正反应的程度大小
C . 若温度升高则各常数一定增大
D . 化学平衡常数越大反应物平衡转化率越大
常温下,某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是( )
A . 3或11
B . 7
C . 8
D . 1
测定 0.1 mol/LNa2SO3溶液先升温再降温过程中的 pH ,数据如下。

实验过程中,取①、④时刻的溶液,加入盐酸酸化的 BaCl2 溶液做对比实验,④产生白色沉淀多。下列说法错误的是( )
A . 此实验中 Na2SO3溶液的 pH 是由 pH 计测定的
B . ④与①的pH不同,是由于 SO32-浓度减小造成的
C . ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D . ①与④的 KW值相等
常温时,将pH为5的HCl溶液与pH为2的H2SO4溶液等体积混合后,溶液的氢氧根离子浓度最接近于( )
A . 2×10-12mol/L
B . 1/2(10-9+10-12)mol/L
C . (10-9+10-12)mol/L
D . 1/2(10-5+10-2)
25℃时,水的电离达到平衡:H2O  H++ OH- ΔH > 0 ,下列叙述正确的是( )
H++ OH- ΔH > 0 ,下列叙述正确的是( )
 H++ OH- ΔH > 0 ,下列叙述正确的是( )
H++ OH- ΔH > 0 ,下列叙述正确的是( )
A . 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B . 向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变
C . 向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D . 将水加热,Kw增大,pH不变
低浓度的氢氟酸是一元弱酸,存在下列两个平衡:HF  H++F- , HF+F-
H++F- , HF+F-  HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
 H++F- , HF+F-
H++F- , HF+F-  HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( ) 
A . c(HF)+c(F-)=2.0amol·L-1
B . c(F-)>c(HF)时,溶液一定呈碱性
C . 随着溶液pH增大,  不断增大
D . 25℃时,HF的电离常数Ka=10-3.45
不断增大
D . 25℃时,HF的电离常数Ka=10-3.45
 不断增大
D . 25℃时,HF的电离常数Ka=10-3.45
不断增大
D . 25℃时,HF的电离常数Ka=10-3.45
0.5mol·L-1CH3COONa溶液和水的pH随温度的变化如图所示,下列分析错误的是( )

A . 25℃,CH3COONa溶液的pH=8.2,显碱性
B . 60℃,H2O中c(H+)=1×10-6.5mol·L-1 , 呈中性
C . 60℃,CH3COONa溶液中c(OH-)=1×10-5.1mol·L-1
D . 升高温度,CH3COONa溶液水解程度和pH都减小
 是一种三元弱酸。关于常温下
是一种三元弱酸。关于常温下 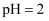 的
的  溶液,下列说法正确的是( )
溶液,下列说法正确的是( )
A . 该溶液中  B . 加水稀释过程中,溶液中
B . 加水稀释过程中,溶液中  保持不变
C . 随温度升高,
保持不变
C . 随温度升高,  增大,该溶液中
增大,该溶液中  增大、
增大、  减小,
减小,  增大
D . 加入
增大
D . 加入  溶液至中性时,溶液中
溶液至中性时,溶液中 
 B . 加水稀释过程中,溶液中
B . 加水稀释过程中,溶液中  保持不变
C . 随温度升高,
保持不变
C . 随温度升高,  增大,该溶液中
增大,该溶液中  增大、
增大、  减小,
减小,  增大
D . 加入
增大
D . 加入  溶液至中性时,溶液中
溶液至中性时,溶液中 
下列说法中正确的是( )
A . 配制 溶液时,加入稀
溶液时,加入稀 抑制
抑制 水解
B . 将纯水加热的过程中,
水解
B . 将纯水加热的过程中, 变大、
变大、 变大
C . 常温下,向
变大
C . 常温下,向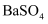 悬浊液中加入少量水,
悬浊液中加入少量水, 减小
D . 向
减小
D . 向 氨水中加入少量水,溶液中
氨水中加入少量水,溶液中 增大
增大
 溶液时,加入稀
溶液时,加入稀 抑制
抑制 水解
B . 将纯水加热的过程中,
水解
B . 将纯水加热的过程中, 变大、
变大、 变大
C . 常温下,向
变大
C . 常温下,向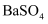 悬浊液中加入少量水,
悬浊液中加入少量水, 减小
D . 向
减小
D . 向 氨水中加入少量水,溶液中
氨水中加入少量水,溶液中 增大
增大
最近更新



