盐类水解的原理 知识点题库
将下列物质的溶液,加热蒸干并灼烧,能够得到原来物质的是( )
A . FeCl3
B . NaHCO3
C . MgSO4
D . Na2SO3
根据题意填空
-
(1) 氯化铝溶液呈性,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):;将该溶液加热蒸干灼烧可得到
-
(2) 碳酸钠溶液呈性,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):;将该溶液加热蒸干灼烧可得到.
在蒸发皿中将下列盐溶液蒸干并灼烧,能得到该物质的固体的是( )
A . 氯化铝
B . 碳酸氢钠
C . 硫酸镁
D . 亚硫酸钠
根据问题填空:
-
(1) 常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3溶液中的一种.已知A、B的水溶液中水的电离程度相同,A、C溶液的pH值相同.
则:①B是溶液,C是.
②常温下若B溶液中c(OH﹣)与C溶液中的c(H+)相同,B溶液的pH用PHb表示,C溶液的pH用pHc表示,则pHb+pHc=(填某个数).
-
(2) 已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测其离子浓度大小顺序有以下几种
①c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) ②c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
③c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+) ④c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
则:(Ⅰ)上述关系一定不正确的是(填序号).
(Ⅱ)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为(填序号).
(Ⅲ)若四种离子浓度关系有c(NH4+)=c(Cl﹣),则该溶液显(填“酸性”、“碱性”或“中性”).
在盐类水解的过程中,下列说法正确的是( )
A . 盐的电离平衡被破坏
B . 水的电离程度一定会增大
C . 溶液的pH一定会增大
D . c(H+)与c(OH-)的乘积一定会增大
已知:pKa=-lgKa,25℃时H2A的pKa1=1.85;pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是( )

A . a点所得溶液中c(HA)+c(A2-)+c(HA-)=0.1mol/L
B . b点所得溶液中:c(H2A)+2c(H+)=c(A2-)+2c(OH-)
C . 对应溶液水的电离程度:a>b>c>d
D . C点所得溶液中:c(Na+)>3c(HA-)
下列化学用语表示正确的是( )
A . H3O+的电子式:  B . 间硝基甲苯的结构简式:
B . 间硝基甲苯的结构简式:  C . 中子数为 10 的氧原子:
C . 中子数为 10 的氧原子:  D . NaHS 显碱性的原因:HS-+H2O=S2-+H3O+
D . NaHS 显碱性的原因:HS-+H2O=S2-+H3O+
 B . 间硝基甲苯的结构简式:
B . 间硝基甲苯的结构简式:  D . NaHS 显碱性的原因:HS-+H2O=S2-+H3O+
D . NaHS 显碱性的原因:HS-+H2O=S2-+H3O+
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合新的物质。根据上述观点,下列说法错误的是( )
A . PCl3的水解产物是PH3和HCl
B . CuCl2的水解产物是Cu(OH)2和HCl
C . NaClO的水解产物是HClO和NaOH
D . CaO2的水解产物是Ca(OH)2和H2O2
向两份等体积、等浓度,pH不同的FeSO4溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图,实验现象如下表。下列说法错误的是( )

| 实验 | 实验现象 |
| Ⅰ | 滴入V1mL NaClO溶液产生大量红褐色沉淀 |
| Ⅱ | 滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加出现红褐色沉淀 |
A . a~b段主要反应的离子方程式为:2Fe2+ + ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+
B . d~e段主要反应的离子方程式为:2Fe2++2ClO-+3H+= HClO + Cl-+ 2Fe3+ + H2O
C . c、f点pH接近的主要原因是:ClO-+ H2O  HClO + OH-
D . 向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出
HClO + OH-
D . 向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出
 HClO + OH-
D . 向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出
HClO + OH-
D . 向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出
下列一句话中叙述了两个值,前者记为 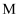 ,后者记为
,后者记为  ,
, 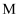 和
和  的关系从A、B、C、D中选择,并填空。
的关系从A、B、C、D中选择,并填空。
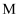 ,后者记为
,后者记为  ,
, 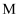 和
和  的关系从A、B、C、D中选择,并填空。
的关系从A、B、C、D中选择,并填空。 A. 
B. 
C. 
D.无法比较
-
(1) 常温下
 的
的  与
与 
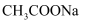 等体积混合后溶液中
等体积混合后溶液中  和
和  :;
:;
-
(2) 同温度下,

 溶液中
溶液中  水解百分率与
水解百分率与  溶液中
溶液中  的水解百分率:;
的水解百分率:;
-
(3) pH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的
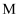 倍和
倍和  倍,稀释后两溶液的
倍,稀释后两溶液的  值仍然相同,则
值仍然相同,则 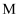 和
和  的关系是:;
的关系是:;
-
(4) 常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中
 :;
:;
-
(5) 相同温度下,
 值为12的烧碱溶液中水的电离度和
值为12的烧碱溶液中水的电离度和  值为12的
值为12的 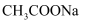 溶液中水的电离度:;
溶液中水的电离度:;
-
(6) 将
 值为2的盐酸和醋酸都稀释相同倍数所得稀溶液的
值为2的盐酸和醋酸都稀释相同倍数所得稀溶液的  值:;
值:;
-
(7) 室温下某强酸和某强碱溶液等体积混合后,溶液的
 值为7,原酸溶液和原碱溶液的物质的量浓度:;
值为7,原酸溶液和原碱溶液的物质的量浓度:;
-
(8) 相同温度下,
 的
的  溶液中的
溶液中的  个数和
个数和 
 溶液中
溶液中  的个数:。
的个数:。
下列说法正确的是( )
A . 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的ΔS<0
B . 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
C . 常温下Ksp(Ag2CrO4)=1.1×10-12 , Ksp(AgCl)=1.8×10-10 , 则Ag2CrO4的溶解度小于AgCl
D . 等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小
下列有关化学用语表示正确的是( )
A . 氮气分子的电子式:  B . Cl-的结构示意图:
B . Cl-的结构示意图:  C . 质子数为53、中子数为78的碘原子:
C . 质子数为53、中子数为78的碘原子:  D .
D .  水解方程式:
水解方程式:  +H2O⇌H3O+ +
+H2O⇌H3O+ + 
 C . 质子数为53、中子数为78的碘原子:
C . 质子数为53、中子数为78的碘原子:  D .
D .  水解方程式:
水解方程式:  +H2O⇌H3O+ +
+H2O⇌H3O+ + 
下列反应不属于水解反应或水解方程式正确的是( )
①HCl+H2O  H3O++Cl− ②NH
H3O++Cl− ②NH  + H2O
+ H2O  NH3·H2O + H+
NH3·H2O + H+
③Na2CO3+2H2O  H2CO3+2NaOH ④Al2(CO3)3+2H2O=2Al(OH)3↓+3CO2↑
H2CO3+2NaOH ④Al2(CO3)3+2H2O=2Al(OH)3↓+3CO2↑
A . ①②
B . ②④
C . ①②④
D . 全部
实验室用TiCl4水解法制备纳米TiO2的简易流程如下,下列说法错误的是( )

A . TiCl4发生水解反应的化学方程式为:TiCl4+(x+2)H2O(少量) = TiO2·xH2O + 4HCl
B . 氨水的作用可用勒夏特列原理解释
C . 可用AgNO3溶液检验沉淀是否洗涤干净
D . 将制得的TiO2纳米颗粒分散到一定溶剂中可产生丁达尔现象
柠檬酸(用H3A表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3A、H2A-、HA2-、A3-的百分含量随pH的变化曲线如图所示。下列说法中错误的是( )

A . 曲线b表示H2A-的变化曲线
B . H3A的第二步电离常数Ka2(H3A)约为10-4.8
C . Na2HA溶液中HA2-的水解程度小于电离程度
D . pH=4时, 

Na2S2O5(焦亚硫酸钠)具有较强的还原性,25℃时,将0.5molNa2S2O5溶于水配成IL溶液,溶液中部分微粒浓度随溶液酸碱性变化如图所示。已知:Ksp(BaSO4)=1.0×10-10 , Ksp(BaSO3)=5.0×10-7。下列说法正确的是( )

A . Na2S2O5水溶液pH=4.5是因为S2O  水解所致
B . 由图像可知,25℃时,HSO
水解所致
B . 由图像可知,25℃时,HSO  的水解平衡常数约为10-7
C . 向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO
的水解平衡常数约为10-7
C . 向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO  )+2c(SO
)+2c(SO  )+c(OH-)
D . 将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO
)+c(OH-)
D . 将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO  沉淀完全[c(SO
沉淀完全[c(SO  )≤1.0×10-5mol·L-1],此时溶液中c(SO
)≤1.0×10-5mol·L-1],此时溶液中c(SO  )≤0.05mol·L-1
)≤0.05mol·L-1
 水解所致
B . 由图像可知,25℃时,HSO
水解所致
B . 由图像可知,25℃时,HSO  的水解平衡常数约为10-7
C . 向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO
的水解平衡常数约为10-7
C . 向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO  )+2c(SO
)+2c(SO  )+c(OH-)
D . 将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO
)+c(OH-)
D . 将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO  沉淀完全[c(SO
沉淀完全[c(SO  )≤1.0×10-5mol·L-1],此时溶液中c(SO
)≤1.0×10-5mol·L-1],此时溶液中c(SO  )≤0.05mol·L-1
)≤0.05mol·L-1
久置的 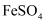 溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中
溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中  被
被  氧化的过程,查阅资料发现:溶液中
氧化的过程,查阅资料发现:溶液中  的氧化过程分为先后两步,首先是
的氧化过程分为先后两步,首先是  水解接着水解产物被
水解接着水解产物被  氧化。于是小组同学决定研究常温下不同pH对
氧化。于是小组同学决定研究常温下不同pH对  被
被  氧化的影响,并测定了
氧化的影响,并测定了  氧化率随时间变化的关系,结果如图。
氧化率随时间变化的关系,结果如图。
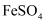 溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中
溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中  被
被  氧化的过程,查阅资料发现:溶液中
氧化的过程,查阅资料发现:溶液中  的氧化过程分为先后两步,首先是
的氧化过程分为先后两步,首先是  水解接着水解产物被
水解接着水解产物被  氧化。于是小组同学决定研究常温下不同pH对
氧化。于是小组同学决定研究常温下不同pH对  被
被  氧化的影响,并测定了
氧化的影响,并测定了  氧化率随时间变化的关系,结果如图。
氧化率随时间变化的关系,结果如图。 
回答下列问题:
-
(1) 写出
 水解的离子方程式;要抑制
水解的离子方程式;要抑制 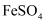 水解,可以采取的措施是。
水解,可以采取的措施是。
-
(2) 若配制的
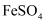 溶液浓度为
溶液浓度为  ,反应过程中溶液体积不变,计算图中P点
,反应过程中溶液体积不变,计算图中P点  的氧化速率。
的氧化速率。
-
(3) 在酸性条件下,
 被
被  氧化的反应方程式为:
氧化的反应方程式为:  ,已知常温下该反应的平衡常数很大。则下列说法正确的是。
,已知常温下该反应的平衡常数很大。则下列说法正确的是。 a.
 转化为
转化为  的趋势很大 b.
的趋势很大 b.  转化为
转化为  的速率很大
的速率很大c.该反应进行得很完全 d.酸性条件下
 不会被氧化
不会被氧化 -
(4) 结合图像分析可知,pH越大
 氧化率越(填“大”或“小”)。
氧化率越(填“大”或“小”)。
-
(5) 研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制
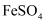 溶液的正确做法是。
溶液的正确做法是。
依据所学知识回答问题:
-
(1) 液态
 是一种似水溶剂,可以微弱电离:
是一种似水溶剂,可以微弱电离:  ,在液态
,在液态  中,视
中,视  为酸,
为酸,  为碱,试写出二者在液态
为碱,试写出二者在液态  体系中发生反应的化学方程式:。
体系中发生反应的化学方程式:。
-
(2) 盐类水解的实质就是盐产生的阴阳离子与水电离出的
 或
或 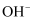 结合的过程,下列物质与水反应和盐类水解类似,写出相应的化学方程式:
结合的过程,下列物质与水反应和盐类水解类似,写出相应的化学方程式:  与水反应:;
与水反应:; 与热水反应:。
与热水反应:。 -
(3) 常温下,
 在水中的溶解平衡曲线如图所示,则该温度下,
在水中的溶解平衡曲线如图所示,则该温度下,  ;将
;将  的
的 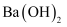 溶液与
溶液与  的
的  溶液等体积混合后,混合溶液中
溶液等体积混合后,混合溶液中  。
。 
-
(1) CH3COONa溶液呈碱性,用离子方程式表示其原因。
-
(2) KSCN是离子化合物,各原子都达到8电子稳定结构,则其电子式为。
-
(3) 石英比干冰熔点高的主要原因是。
常温下,向25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,滴定曲线如图所示。

下列说法中错误的是( )
A . a点对应的M=13
B . b点对应的N>12.5
C . 曲线ab(不含a、b点)上总是存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D . c点对应的溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
最近更新



