盐类水解的应用 知识点
盐类水解的应用:利用盐类水解在实际生活生产方面应用。比如明矾的净水原理,是利用盐类水解生成胶体而达到净水作用;泡沫灭火器是利用碳酸氢钠和硫酸铝发生双水解制取二氧化碳而达到灭火作用;再如利用双水解原理避免草木灰和铵态氮肥混合使用等。
盐类水解的应用 知识点题库
实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是()
A . 防止硫酸铁分解
B . 抑制硫酸铁水解
C . 提高硫酸铁的溶解度
D . 提高溶液的pH
稀土元素号称“工业维生素”,科学家把稀土元素镧对作物的作用赋予“超级钙”的美称.已知镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3 , La(OH)3是不溶于水的弱碱,而LaCl3、La(NO3)3都可溶于水,下列说法中正确的是( )
A . La(NO3)3水溶液显酸性
B . LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3
C . La和盐酸反应的离子方程式为:La+2H+=La3++H2↑
D . 镧有两种核素: 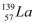 和放射性
和放射性 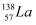 ,由此可知镧元素的相对原子质量为138.5
,由此可知镧元素的相对原子质量为138.5
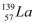 和放射性
和放射性 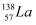 ,由此可知镧元素的相对原子质量为138.5
,由此可知镧元素的相对原子质量为138.5
下列关于醋酸钠溶液的说法中正确的是( )
A . 溶液呈酸性
B . c(H+)=c(CH3COO﹣)+c(OH﹣)
C . c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D . c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
将①H+、②NH4+、③NO3﹣、④K+、⑤CO32﹣、⑥OH﹣分别加入H2O中,基本上不影响水的电离平衡的是( )
A . ③④
B . ②③⑥
C . ①⑥
D . ②④
下列离子方程式中,能正确表示盐的水解反应的是( )
A . NH4++H2O⇌NH3•H2O+H+
B . Fe3++3H2O═Fe(OH)3↓+3H+
C . S2﹣+2H2O═H2S+2OH﹣
D . Br﹣+H2O═HBr+OH﹣
下列物质的水溶液因水解而呈酸性的是( )
A . NaHSO3
B . AgNO3
C . H2CO3
D . NaCl
化学与人类的生活、生产息息相关,下列叙述正确的是( )
A . “青蒿一握,以水二升渍,绞取计”,提取青蒿素的过程属于化学变化
B . 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
C . 日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同
D . “84消毒液”的有效成分为NaClO,“洁厕灵”的有效成分为HCl,若将两者混合使用,其杀菌效果和去除厕所污溃的效果都将加强
工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
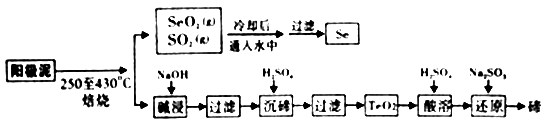
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
-
(1) “培烧”时,为提高原料的利用率,可采取的措施有(写一条即可)。
-
(2) “碱浸”过滤得到滤渣的主要成分是(填化学式)。
-
(3) “沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为。
-
(4) “酸溶”将TeO2先溶于硫酸得到Te(SO4)2 , 然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是。
-
(5) SeO2与SO2的混合烟气可用水吸收制得单质Se,当有10mol电子转移时,会生成mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是。
-
(6) 常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH7(填“>”“<”或“=”),理由是。(已知25℃时,亚硒酸(HSeO3)的Ka1=2.5×10-3 , Ka2=2.6×10-7)
现有常温下0.1mol/L的Na2SO4溶液。欲使此溶液中水的电离平衡向右移动,且pH<7,有下列措施:①给溶液加热;②加入少量稀硫酸;③加入NH4Cl晶体;④加入CH3COONa固体;⑤加入BaCl2溶液;⑥加入FeCl3溶液。其中能达到目的的是( )
A . ①③⑥
B . ①②③
C . ②③④
D . ③⑤⑥
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
-
(1) FeCl3净水的原理是。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)。
-
(2) 为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1 , c(Fe3+)=1.0×10-3mol·L-1 , c(Cl-)=5.3×10-2mol·L-1 , 则该溶液的pH约为。
②完成NaClO3氧化FeCl2的离子方程式:
ClO3-+Fe2+ + = Cl-+ Fe3++ 。
-
(3) FeCl3在溶液中分三步水解:
Fe3+ + H2O
 Fe(OH)2+ + H+ K1
Fe(OH)2+ + H+ K1Fe(OH)2+ + H2O
 Fe(OH)2+ + H+ K2
Fe(OH)2+ + H+ K2Fe(OH)2+ + H2O
 Fe(OH)3 + H+ K3
Fe(OH)3 + H+ K3以上水解反应的平衡常数K1、K2、K3由大到小的顺序是。
通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:
xFe3++ yH2O
 Fex(OH)y(3x-y)+ + yH+ , 欲使平衡正向移动可采用的方法是(填序号)。
Fex(OH)y(3x-y)+ + yH+ , 欲使平衡正向移动可采用的方法是(填序号)。a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是。
下列说法不具有因果关系的是( )
A . 明矾溶于水后生成氢氧化铝胶体,因此具有净水能力
B . 纯碱水溶液呈碱性,因此可以去油污
C . 二氧化硅与氢氧化钠溶液反应生成硅酸钠,因此装氢氧化钠溶液的试剂瓶不能用玻璃塞
D . SO2具有漂白性,因此能使酸性高锰酸钾溶液褪色
 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A .  ,
,  完全反应转移的电子数为
完全反应转移的电子数为 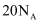 B . 用电解粗铜的方法精炼铜,当电路中通过的电子数为
B . 用电解粗铜的方法精炼铜,当电路中通过的电子数为  时,阳极应有
时,阳极应有  转化为
转化为  C . 常温下,
C . 常温下, 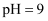 的
的 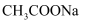 溶液中,水电离出的
溶液中,水电离出的  数为
数为  D .
D . 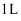 浓度为
浓度为 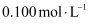 的
的  溶液中,阴离子数为
溶液中,阴离子数为 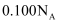
 ,
,  完全反应转移的电子数为
完全反应转移的电子数为 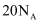 B . 用电解粗铜的方法精炼铜,当电路中通过的电子数为
B . 用电解粗铜的方法精炼铜,当电路中通过的电子数为  时,阳极应有
时,阳极应有  转化为
转化为  C . 常温下,
C . 常温下, 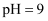 的
的 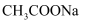 溶液中,水电离出的
溶液中,水电离出的  数为
数为  D .
D . 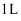 浓度为
浓度为 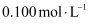 的
的  溶液中,阴离子数为
溶液中,阴离子数为 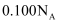
常温下,浓度相同的稀溶液:①NH4Cl溶液、②NH4Al(SO4)2溶液、③CH3COONH4溶液、④氨水中,c(NH4+)由大到小的排列顺序为( )
A . ①>②>③>④
B . ②>①>④>③
C . ②>①>③>④
D . ④>③>②>①
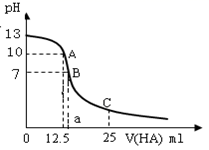
25℃时,向25ml氢氧化钠标准溶液中逐滴加入0.2mol·L−1的一元酸HA溶液,PH变化曲线如下图所示:
-
(1) 该氢氧化钠溶液的物质的量浓度为mol·L−1。
-
(2) A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH−)= mol·L−1。
-
(3) HA是酸(选填“强”、“弱”)。
-
(4) 在B点所得混合溶液中,c(Na+)、c(A−)、c(H+)、c(OH−) 的大小的顺序是。
-
(5) 在C点所得混合溶液中,下列说正确的是________。A . HA的电离程度小于NaA的水解程度 B . 离子浓度由大到小的顺序是c(Na+)>c(A−)>c(H+)>c(OH−) C . c(Na+) + c(H+) = c(A-) + c(OH−) D . c(HA) + c(A−) = 0.2mol·L−1
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH。下列说法错误的是( )
A . 浓度均为0.1mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B . 0.1mol·L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C . NaF溶液中含有Na+、F-、H+、OH-、H2O、HF六种微粒
D . NaF溶液中加入少量NaOH固体,溶液中c(F-)增大
25℃,有pH相等的CH3COONa和NaHCO3两种溶液,下列说法正确的是( )
A . c(CH3COONa)<c(NaHCO3)
B . 水解程度:  >CH3COO-
C . 所含离子总数相等
D . 加水稀释,pH均增大
>CH3COO-
C . 所含离子总数相等
D . 加水稀释,pH均增大
 >CH3COO-
C . 所含离子总数相等
D . 加水稀释,pH均增大
>CH3COO-
C . 所含离子总数相等
D . 加水稀释,pH均增大
下列物质,因水解而使溶液呈酸性的是( )
A . CH3COOH
B . NaHCO3
C . NH4Cl
D . HCl
室温下,向亚硫酸溶液中滴加NaOH溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物质的量之和的分数)与溶液pH的关系如图所示。下列说法不正确的是( )
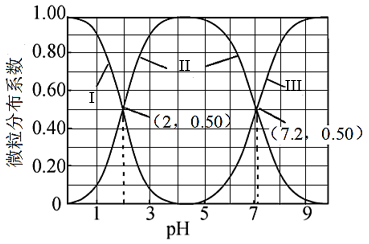
A . 曲线II表示HSO 的分布系数随pH的变化
B . Ka2(H2SO3)的数量级为10−8
C . pH=7时,c(Na+)<3c(SO
的分布系数随pH的变化
B . Ka2(H2SO3)的数量级为10−8
C . pH=7时,c(Na+)<3c(SO )
D . NaHSO3溶液中水电离出的c(H+)<1×10−7 mol·L−1
)
D . NaHSO3溶液中水电离出的c(H+)<1×10−7 mol·L−1
 的分布系数随pH的变化
B . Ka2(H2SO3)的数量级为10−8
C . pH=7时,c(Na+)<3c(SO
的分布系数随pH的变化
B . Ka2(H2SO3)的数量级为10−8
C . pH=7时,c(Na+)<3c(SO )
D . NaHSO3溶液中水电离出的c(H+)<1×10−7 mol·L−1
)
D . NaHSO3溶液中水电离出的c(H+)<1×10−7 mol·L−1
草酸亚铁晶体是生产感光材料的原料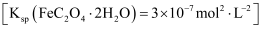 , 制备流程如下:
, 制备流程如下:
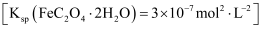 , 制备流程如下:
, 制备流程如下:
下列说法错误的是( )
A . 可用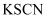 溶液检验
溶液检验 是否变质
B . 步骤①酸化的目的是抑制
是否变质
B . 步骤①酸化的目的是抑制 的水解
C . 步骤②反应为
的水解
C . 步骤②反应为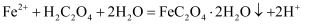 D . 步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D . 步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
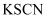 溶液检验
溶液检验 是否变质
B . 步骤①酸化的目的是抑制
是否变质
B . 步骤①酸化的目的是抑制 的水解
C . 步骤②反应为
的水解
C . 步骤②反应为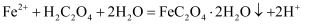 D . 步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D . 步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
常温下向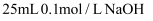 中逐滴滴加
中逐滴滴加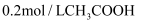 溶液,pH的变化曲线如图(溶液混合时体积的变化忽略不计)。下列说法正确的是( )
溶液,pH的变化曲线如图(溶液混合时体积的变化忽略不计)。下列说法正确的是( )
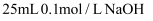 中逐滴滴加
中逐滴滴加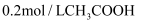 溶液,pH的变化曲线如图(溶液混合时体积的变化忽略不计)。下列说法正确的是( )
溶液,pH的变化曲线如图(溶液混合时体积的变化忽略不计)。下列说法正确的是( )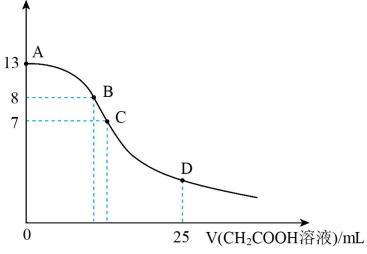
A . 水电离出的 :A点大于B点
B . 在B点,离子浓度大小为
:A点大于B点
B . 在B点,离子浓度大小为 C . 在C点,滴加的
C . 在C点,滴加的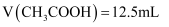 D . 在D点,
D . 在D点,
 :A点大于B点
B . 在B点,离子浓度大小为
:A点大于B点
B . 在B点,离子浓度大小为 C . 在C点,滴加的
C . 在C点,滴加的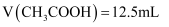 D . 在D点,
D . 在D点,
最近更新



