常见离子的检验 知识点题库
 、CO
、CO  、X中的一种.
、X中的一种.
-
(1) 某同学通过分析比较,认为无需检验就可判断其中必有的两种物质是和.(填化学式)
-
(2) 物质丙中含有离子X.为了确定X,现将(1)中的两种物质记为甲和乙,当丙与甲的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀硝酸,沉淀部分溶解,剩余白色固体,则物质丙为.(填化学式)
-
(3) 将19.2g Cu投入装有足量丁溶液的试管中,Cu不溶解,再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式,若要将Cu完全溶解,至少加入硫酸的物质的量是.
-
(4) 戊溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为.

I.观察待测液的颜色,溶液呈无色;
Ⅱ,取少量待测液,滴加NaOH溶液,先无明显现象,后有白色沉淀生成;
Ⅲ.另取少量待测液,加入BaCl2溶液,无明显现象.
回答下列问题:
-
(1) 据此可以判断该待测液中一定大量存在的离子是,一定不能大量存在的离子是,不能确定是否存在的离子是.
-
(2) 依次写出Ⅱ中加入NaOH溶液过程中发生反应的离子方程式:,.

-
(1) 溶液X中除了H+一定存在的离子有.溶液X中一定不存在的离子有.
-
(2) 产生气体A的离子方程式为.
-
(3) 转化⑥发生反应的现象为.
-
(4) 转化 ⑤中的离子方程式为.
-
(5) 若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中O2与D的物质的量之比为.
Ⅰ操作 | Ⅱ结论 | |
A | 滴加BaCl2溶液生成白色沉淀 | 原溶液中有SO42﹣ |
B | 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 | 原溶液中有Na+无K+ |
C | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
D | 滴加氯水和CCl4 , 振荡、静置.下层溶液显紫色 | 原溶液中有I﹣ |

选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42﹣ |
B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32﹣ |
D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液,再加稀HNO3 | 生成白色沉淀,且沉淀不溶解 | 原溶液中有SO42﹣ |
| B | 滴加氯水和CCl4 , 振荡、静置 | 下层溶液显紫红色 | 原溶液中有I﹣ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、K+ |
| D | 滴加NaOH溶液加热,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
①取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据对上述实验的分析判断,最后得出的结论合理的是( )
 、②
、②  、③
、③  、④
、④  、⑤
、⑤  、⑥
、⑥  、⑦
、⑦  中的几种,且每种离子的浓度均相等。依次进行下列实验,每步所加试剂均过量,观察到的现象如表所示:
中的几种,且每种离子的浓度均相等。依次进行下列实验,每步所加试剂均过量,观察到的现象如表所示: | 步骤 | 操作 | 现象 |
| (1) | 向溶液中滴加2~3滴紫色石蕊溶液 | 溶液变红 |
| (2) | 向溶液中滴加 | 有白色沉淀生成 |
| (3) | 将(2)中所得沉淀过滤,向滤液中加入 | 有白色沉淀生成 |
下列结论正确的是( )
 离子反应是中学化学中重要的反应类型,回答下列问题:
离子反应是中学化学中重要的反应类型,回答下列问题:
-
(1) Ⅰ、下列物质:①铜②纯碱③Ba(OH)2 固体④
 ⑤盐酸溶液⑥酒精⑦熔融的 NaCl⑧二氧化碳
⑤盐酸溶液⑥酒精⑦熔融的 NaCl⑧二氧化碳
属于盐类的是。
-
(2) 属于非电解质是。
-
(3) 属于电解质的是。
-
(4) Ⅱ、将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子: K+、Mg2+、Fe3+、Ba2+、SO42-、OH-、CO32-和 Cl- ,取该溶液进行如下实验:
Ⅰ取少量溶液滴入紫色石蕊试液,溶液呈蓝色。
Ⅱ取少许溶液滴入 BaCl2 溶液,无白色沉淀产生。
Ⅲ取少许溶液先滴加硝酸再加
 溶液,产生白色沉淀。
溶液,产生白色沉淀。Ⅳ再取少许原溶液滴入少量
 溶液,有白色沉淀产生。
溶液,有白色沉淀产生。① 根据以上现象判断,原溶液中肯定不存在的离子是。
② 写出实验Ⅲ中可能发生反应的离子方程式,。
③ 如溶液中各种离子数相等,确定溶液中(填有或无)
 。判断依据是。
。判断依据是。
-
(1) 实验步骤如下,请补全空白:
①用洁净的铂丝蘸取少许溶液,在酒精灯上灼烧,透过观察,火焰呈紫色,说明溶液中含有。
②取少量溶液于试管中,滴加NaOH溶液产生白色沉淀,继续滴加NaOH溶液,沉淀溶解。
③另取少量溶液于试管中,先滴加酸化,再加入,若有白色沉淀产生,则证明溶液中有SO
 。
。 -
(2) 步骤②的实验现象说明盐溶液中含有,写出沉淀溶解时发生反应的离子方程式。
-
(3) 若该溶液的溶质只有一种,根据实验结果判断该溶质应为。
 溶液和稀盐酸
溶液和稀盐酸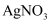 溶液和稀硝酸
溶液和稀硝酸


