常见离子的检验 知识点题库
下列有关实验原理、方法和结论都正确的是( )
A . 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,该无机酸一定为盐酸
B . 向含少量苯酚的苯中加入适量溴水后过滤,可除去苯酚
C . 向KI淀粉溶液中滴入氯水变蓝,再通入SO2 , 蓝色褪去,说明SO2具有还原性
D . 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42-
某无色溶液中只可能含有①Na+ 、②Ba2 +、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
(1)用pH试纸检验,溶液的pH大于7
(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙色
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生.
下列结论正确的是
A . 肯定含有的离子是③④⑤
B . 肯定没有的离子是②⑤
C . 可能含有的离子是①⑥
D . 不能确定的离子是③⑥
下列实验事实所得出的结论中,错误的是( )
A . 向AgCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶
B . 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-
C . 先加入盐酸无沉淀,再加入BaCl2溶液产生白色沉淀,则试样中一定有SO42-
D . 盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐
某化合物A是一种易溶于水的不含结晶水盐,溶于水后可完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子.用A进行如下实验:
(1)取2.370g A溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,当气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.
(2)另取少量的A溶于水,向其中加入足量的稀盐酸酸化,无沉淀产生,再加入氯化钡溶液,有白色沉淀生成.
回答下列问题:
-
(1) A中存在的离子:阳离子是 ;阴离子是
-
(2) 画出沉淀B中金属元素的原子结构示意图
-
(3) 化合物A的化学式为
-
(4) 写出沉淀B溶解在氢氧化钠溶液中的离子方程式
-
(5) 写出气体C与氯气发生氧化还原反应的化学方程式
某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+ . 某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中( )
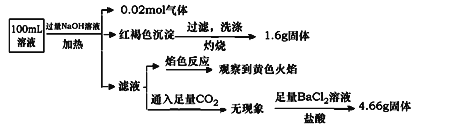
A . 原溶液中c(Fe3+)=0.2 mol•L﹣1
B . 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L﹣1
C . SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在
D . 要确定原溶液中是否含有Fe2+ , 其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+
下列说法不正确的是( )
A . 某试样焰色反应呈黄色,则试样中一定含有Na+
B . 精密pH试纸测得某碱性溶液的pH为12.5
C . 容量瓶不能用作溶解物质的容器
D . 粗盐的提纯试验中,滤液在蒸发皿中加热蒸发结晶
对某些离子的检验及结论一定正确的是( )
A . 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42﹣
B . 通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I﹣
C . 加入碳酸钠溶液有白色沉淀生成,再加盐酸,沉淀消失,则原溶液中一定有Ba2+
D . 加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液一定有NH4+
有一瓶澄清溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl﹣、I﹣、NO3﹣、CO32﹣、SO32﹣中的几种.取该溶液进行以下实验:
-
(1) 用pH试纸检验,表明溶液呈强酸性.排除存在.
-
(2) 取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡,CCl4层呈紫红色.排除存在.
-
(3) 另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生.则可排除存在.取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
-
(4) 另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成.证明存在,又排除存在.
-
(5) 根据上述实验事实确定:①该溶液中肯定存在的离子是;②还不能确定是否存在的离子是.
用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A . 检验试液中的SO42﹣:试液 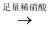 无沉淀
无沉淀 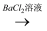 白色沉淀
B . 检验试液中的SO32﹣:试液
白色沉淀
B . 检验试液中的SO32﹣:试液  气体
气体 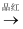 褪色
C . 检验试液中的I﹣:试液
褪色
C . 检验试液中的I﹣:试液  棕黄色溶液
棕黄色溶液  蓝色溶液
D . 检验试液中的CO32﹣:试液
蓝色溶液
D . 检验试液中的CO32﹣:试液  白色沉淀
白色沉淀  沉淀溶解
沉淀溶解
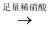 无沉淀
无沉淀 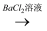 白色沉淀
B . 检验试液中的SO32﹣:试液
白色沉淀
B . 检验试液中的SO32﹣:试液  气体
气体 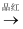 褪色
C . 检验试液中的I﹣:试液
褪色
C . 检验试液中的I﹣:试液  棕黄色溶液
棕黄色溶液  蓝色溶液
D . 检验试液中的CO32﹣:试液
蓝色溶液
D . 检验试液中的CO32﹣:试液  白色沉淀
白色沉淀  沉淀溶解
沉淀溶解
由几种离子化合物组成的混合物,含有以下离子中的若干种:
K+、NH4+、Mg2+、Ba2+、Cl﹣、SO42﹣、CO32﹣ . 将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
A | 加AgNO3溶液 | 有白色沉淀生成 |
B | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27g,第二次称量沉淀质量为2.33g |
试回答下列问题:
-
(1) 根据实验A判断Cl﹣是否存在(填“一定存在”、“一定不存在”或“不能确定”).
-
(2) 该混合物中一定不存在的离子是.
-
(3) 写出实验B中发生反应的离子方程式.
-
(4) 混合物中是否存在K+ , 写出判断过程?
某澄清透明溶液中只可能含有:Al3+、Mg2+、Fe3+、Fe2+、H+、CO32﹣、NO3﹣中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是( )

A . Mg2+、H+、NO3﹣
B . Mg2+、Fe3+、H+、NO3﹣
C . Fe3+、H+、NO3﹣
D . Cu2+、H+、NO3﹣
下列鉴别方法可行的是( )
A . 用氨水鉴别Al3+、Mg2+和Ag+
B . 用Ba(NO3)2溶液鉴别Cl-、SO32-和CO32-
C . 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D . 用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
用可溶性钡盐检验SO42-的存在时,先在待测溶液中加入盐酸,其作用是( )
A . 形成较多的白色沉淀
B . 使形成沉淀的纯度更高
C . 排除SO42-以外的其他阴离子及Ag+的干扰
D . 排除Ba2+以外的其他阳离子的干扰
对下列实验过程的评价,正确的是( )
A . 某溶液中滴加BaCl2溶液,生成不溶于稀HNO3的白色沉淀,证明一定含有SO42﹣
B . 某溶液中加入NaOH溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,证明该溶液含有NH4+
C . 某溶液中加入AgNO3溶液,有白色沉淀生成,证明一定含有Cl﹣存在
D . 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A . 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl﹣存在
B . 通入Cl2后,无色溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I﹣存在
C . 加入BaCl2溶液,生成白色沉淀,加稀硝酸后沉淀不溶解时,可确定有SO42﹣存在
D . 加入NaOH溶液,加热,生成的气体能使湿润的蓝色石蕊试纸变红,可确定有NH4+存在
有一无色溶液,可能含有Fe3+、K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
A . 肯定有Al3+、Mg2+、NH4+
B . 肯定有Al3+、Mg2+、HCO3-
C . 肯定有K+、MnO4-
D . 肯定有Al3+、Mg2+、SO42-
下列有关实验原理、方法和结论都正确的是( )
A . 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中不一定含有SO42-
B . 向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解。
C . 等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB
D . 淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解。
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1,某同学进行了如下实验,下列说法正确的是
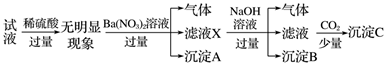
A . 无法确定原试液中是否含有Al3+、Cl-
B . 原溶液中存在NH4+、Fe2+、Cl-、SO42-
C . 无法确定沉淀C的成分
D . 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
有一无色溶液,其中可能含有  、
、  、
、  、
、  、
、  、
、  、
、  、
、  、
、  等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
 、
、  、
、  、
、  、
、  、
、  、
、  、
、  、
、  等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下: 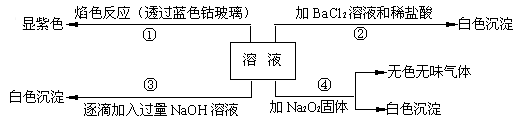
第③个实验中,生成白色沉淀的量与加入  的量有如下图所示的相互关系。据此可知:
的量有如下图所示的相互关系。据此可知:

-
(1) 在原溶液中一定存在的离子有;一定不存在的离子有;不能确定是否存在的离子有。
-
(2) 写出第③个实验中发生反应的离子方程式。
下列有关实验的说法正确的是( )
A . 用刀切取金属钠,多余的钠应放回试剂瓶
B . 用 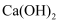 溶液可鉴别
溶液可鉴别  溶液和
溶液和 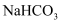 溶液
C . 蒸馏操作使用的温度计的水银球应插入液体内
D . 某溶液中加入盐酸能产生无色气体,则该溶液中一定含有
溶液
C . 蒸馏操作使用的温度计的水银球应插入液体内
D . 某溶液中加入盐酸能产生无色气体,则该溶液中一定含有 
 溶液可鉴别
溶液可鉴别  溶液和
溶液和 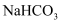 溶液
C . 蒸馏操作使用的温度计的水银球应插入液体内
D . 某溶液中加入盐酸能产生无色气体,则该溶液中一定含有
溶液
C . 蒸馏操作使用的温度计的水银球应插入液体内
D . 某溶液中加入盐酸能产生无色气体,则该溶液中一定含有 
最近更新



