物质结构与性质 知识点题库
汽车尾气中的氮氧化物对大气造成污染,NO是其组成之一.已知N和O的核电荷数分别是7和8,则2个NO分子共含有的电子个数为( )
A . 14
B . 15
C . 16
D . 30
以下说法正确的是( )
A . 共价化合物内部可能有极性键和非极性键
B . 原子或离子间相互的吸引力叫化学键
C . 非金属元素的原子间只能形成共价键
D . 金属元素与非金属元素的原子间只形成离子键
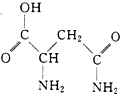
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
-
(1) 天冬酰胺所含元素中,(填元素名称)元素基态原子核外未成对电子数最多.
-
(2) 天冬酰胺中碳原子的杂化轨道类型有、.
-
(3) H2Se的晶体类型为,含有的共价键类型为.
-
(4) 已知钼(Mo)位于第五周期、ⅥB族,钼、铬、锰的部分电离能如表所示:
编号
I5/kJ•mol﹣1
I6/kJ•mol﹣1
I7/kJ•mol﹣1
I8/kJ•mol﹣1
A
6990
9220
11500
18700
B
6702
8745
15455
17820
C
5257
6641
12125
13860
A是(填元素符号),B原子的价电子排布式为.
在35Cl中含有个电子,个中子,氯在周期表中位置.
下列每组物质中含有的化学键类型相同的是( )
A . NaCl、HCl、H2O、NaOH
B . Cl2、Na2S、HCl、CO2
C . HBr、CCl4、H2O、CO2
D . Na2O2、H2O2、H2O、O2
下列说法正确的是( )
A . 只含离子键的化合物称为离子化合物
B . 化学键不仅存在于原子间,也存在于分子间
C . 原子间通过极性键结合成分子的物质,一定是共价化合物
D . 不同元素组成的多原子分子里的化学键一定是极性键
氮化硼是一种新合成的无机材料,它是一种超硬耐磨、耐高温、抗腐蚀的物质。下列各组物质熔化时所克服的粒子间的作用力与氮化硼熔化时所克服的粒子间的作用力类型相同的是( )
A . 硫酸钠和金刚石
B . 冰和干冰
C . 晶体硅和水晶
D . 苯和四氯化碳
X、Y、Z、W、Q为原子序数依次增大的前四周期元素。Ⅹ元素原子核外s电子总数和p电子总数相等,且位于元素周期表第十六列;Y是地壳中含量最多的金属元素;Z与Y同周期,其基态原子中未成对电子数是同周期元素中最多的;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且未成对电子数为最外层电子数的2倍。据此回答下列问题:
-
(1) Q的基态原子的价层电子排布式为。
-
(2) 上述五种元素中电负性最大的是 (填元素符号),第一电离能介于Y和Z之间的同周期元素有(填元素符号)。
-
(3) Y和W的氯化物熔点高的是(填化学式),原因是;与Z的低价氯化物互为等电子体的离子是。
-
(4) 咖啡因对中枢神经有兴奋作用,其结构简式如图。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是,分子中碳原子的杂化类型有。

-
(5) 奥氏体是碳溶解在Q中形成的一种间隙固溶体,其晶胞为面心立方结构,如图所示,则该物质的化学式为。若晶体密度为dg·cm-3 , 则晶胞中最近的两个碳原子的距离为pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。

短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是( )
A . Y和W的含氧酸均为强酸
B . 由化合物YX5是一种离子化合物,该物质与水反应生成气体X2 , 同时得到一种弱碱溶液
C . YW3分子的空间构型为平面三角形
D . 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z
下列叙述正确的是( )
A . 由极性键结合而成的分子一定是极性分子
B . 非极性键只存在于双原子单质分子里
C . 非极性分子中,一定含有非极性键
D . 一般情况下,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂
用价层电子对互斥理论预测H2S和NH3的立体结构,两个结论都正确的是( )
A . 直线形;三角锥形
B . V形;三角锥形
C . 直线形;平面三角形
D . V形;平面三角形
短周期元素X、Y、Z、W的原子序数依次增大,X的L层电子数是K层的3倍,W所在的族序数是周期数的2倍,Y、Z、W的最外层电子数之和为10。下列说法正确是( )
A . Y可以从溶液中置换出Z单质
B . Y、Z、W三种元素最高价氧化物对应水化物两两之间可以反应
C . X和W形成的化合物的水化物一定是强电解质
D . 单核离子半径:W>Z>Y>X
溴及其化合物可被用作阻燃剂,下列有关  和
和  的说法正确的是( )
的说法正确的是( )
 和
和  的说法正确的是( )
的说法正确的是( )
A .  和
和  所含有的电子数不同
B .
所含有的电子数不同
B .  和
和  都含有35个中子
C .
都含有35个中子
C .  和
和  分别含有44和46个质子
D .
分别含有44和46个质子
D .  和
和  是两种不同的核素
是两种不同的核素
 和
和  所含有的电子数不同
B .
所含有的电子数不同
B .  和
和  都含有35个中子
C .
都含有35个中子
C .  和
和  分别含有44和46个质子
D .
分别含有44和46个质子
D .  和
和  是两种不同的核素
是两种不同的核素
氮原子可以形成σ键、π键、大π键和配位键,成键的多样性使其形成了多种具有独特组成的物质。回答下列问题:
-
(1) 1mol配合物K4[Fe(CN)6]中含σ键的数目为,基态氮原子价电子排布图不是
 ,是因为该排布方式违背了。
,是因为该排布方式违背了。
-
(2) 肼(N2H4)的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是。
-
(3) 正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①Na3NO4阴离子的空间构型为,其中心原子杂化方式为。
②分别写出一种与Na3NO4的阴离子互为等电子体的阴离子和分子、(填化学式)。
-
(4) 冰的晶体结构模型如图a,它的晶胞与金刚石相似如图b,水分子之间以氢键相连接,一个水分子平均形成个氢键,若晶胞参数为d nm,则晶体密度计算式为g·cm-3 (用NA表示阿伏加德罗常数的值,不用化简)。

下列有关说法错误的是( )
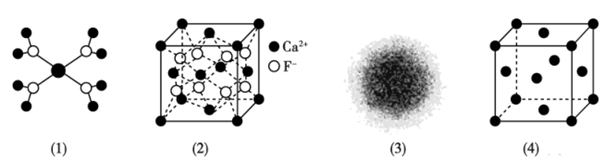
A . 水合铜离子的模型如图(1)所示,1个水合铜离子中有4个配位键
B . CaF2晶体的晶胞如图(2)所示,与每个Ca2+ 等距离F- 有4个
C . H原子的电子云图如图(3)所示,电子在原子核附近运动出现的概率大
D . 金属Cu中Cu原子晶胞模型如图(4),立方最密堆积,每个Cu原子的配位数均为8
下列分子中所有原子均满足最外层8电子结构的是( )
A . LiCl
B . BF3
C . PCl5
D . NCl3
下列关于Si、P、S、Cl及其化合物结构与性质的论述错误的是( )
A . 中心原子的半径依次减小是H4SiO4、H3PO4、H2SO4、HClO4中羟基的数目依次减小的原因之一
B . 结构简式为  Cl-的物质中含有不对称原子P,该物质可能有旋光性
C . SiCl4、PCl3、SCl2中键角最大的是PCl3
D . 实验测定分子的极性大小可以区别顺-1,2-二氯乙烯和反-1,2-二氯乙烯
Cl-的物质中含有不对称原子P,该物质可能有旋光性
C . SiCl4、PCl3、SCl2中键角最大的是PCl3
D . 实验测定分子的极性大小可以区别顺-1,2-二氯乙烯和反-1,2-二氯乙烯
 Cl-的物质中含有不对称原子P,该物质可能有旋光性
C . SiCl4、PCl3、SCl2中键角最大的是PCl3
D . 实验测定分子的极性大小可以区别顺-1,2-二氯乙烯和反-1,2-二氯乙烯
Cl-的物质中含有不对称原子P,该物质可能有旋光性
C . SiCl4、PCl3、SCl2中键角最大的是PCl3
D . 实验测定分子的极性大小可以区别顺-1,2-二氯乙烯和反-1,2-二氯乙烯
丙氨酸(C3H7NO2)分子为手性分子,存在手性异构体,其结构如图所示:

下列关于丙氨酸的两种手性异构体(Ⅰ和Ⅱ)的说法正确的是( )
A . Ⅰ和Ⅱ分子中均存在1个手性碳原子
B . Ⅰ和Ⅱ呈镜面对称,都是非极性分子
C . Ⅰ和Ⅱ分子都只含有极性键,不含非极性键
D . Ⅰ和Ⅱ所含的化学键相同
下列过程中,共价键被破坏的是( )
①溴蒸气被木炭吸附
②石英熔化
③酒精溶于水
④ 气体溶于水
气体溶于水
⑤碘升华
⑥ 受热分解
受热分解
⑦氢氧化钠熔化
⑧ 溶于水
溶于水
A . ②④⑥
B . ④⑤⑥
C . ①④⑧
D . ①④⑥
储氢合金LaNi5、LaCo5、CeCo5等结构和CaCu5相同。CaCu5合金由图甲、乙两个原子层交替密堆积而成,丙是CaCu5的晶体结构。

下列说法正确的是( )
A . CaCu5晶体类型为离子晶体
B . 晶体中Ca原子与6个Cu原子配位
C . CaCu5晶体的一个晶胞中Cu原子数为15
D . LaNi5晶胞体积为9×10-23cm-3 , 储氢后形成LaNi5H4.5的合金,氢进入晶胞空隙,体积不变,氢在合金中的密度约为0.083g•cm-3
最近更新



