物质结构与性质 知识点题库
下列五种物质中,①Ar,②CO2 , ③SiO2 , ④NaOH,⑤K2S,只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是.
下列分子或离子中不能跟质子结合的是( )
A . NH3
B . H2O
C . Ca2+
D . OH﹣
下面的排序不正确的是( )
A . 晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B . 硬度由大到小:金刚石>碳化硅>晶体硅
C . 熔点由高到低:Na>Mg>Al
D . 离子键由强到弱:NaF>NaCl>NaBr>NaI
下列各组物质中,化学键类型不同的是( )
A . NaCl和K2S
B . H2O和NH3
C . CaF2和CsCl
D . CCl4和Na2O
已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为( )
A . -332
B . -118
C . +350
D . +130
下列物质属于等电子体的一组是( )
A . CH4和NH3
B . B3H6N3和C6H6
C . F-和Mg
D . H2O和CH4
下列说法正确的是( )
A . MgF2中的两种离子核外排布相差一个电子层
B . 石英和硫磺晶体熔化时克服相同类型的微粒间作用力
C . 发生物理变化时物质中的化学键也可能被破坏
D . H2O和H2O2的稳定性不同是因为微粒间作用力不同
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A . ③④⑥
B . ①②③
C . ④⑤⑥
D . ①③⑤
下列分子或离子中,立体构型是平面三角形的是( )
A . CH4
B . NH4+
C . NO3-
D . CO2
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键的夹角为120°,它能水解,有关叙述正确的是( )
A . 氯化硼液态时能导电而固态时不导电
B . 氯化硼中心原子采用sp杂化
C . 氯化硼分子呈正三角形,属非极性分子
D . 三氯化硼遇水蒸气不会产生白雾
下列有关说法正确的是( )
A . 由H原子形成1molH-H键要吸收热量
B . 在稀溶液中,酸与碱中和生成水时释放的热量称为中和热
C . 氮气非常稳定,是因为氮气分子里含有氮氮三键,要破坏氮氮三键需吸收更多的能量
D . 凡经加热而发生的化学反应都是吸热反应
氮氧化铝(AlON)是一种硬度超强透明材料,下列描述正确的是( )
A . AlON和石英的化学键类型相同
B . AlON不属原子晶体
C . AlON和Al2O3的组成微粒相同
D . AlON和AlCl3晶型相同
有机物E是从中药地钱中分离提取的天然活性物质,其结构如图。下列说法正确的是( )

A . 分子中含有三种官能团
B . E与足量H2加成所得产物存在对映异构
C . 分子中最多有8个碳原子共面
D . 1molE与足量溴水反应,消耗1molBr2
-
(1) CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,基态Cr原子的价层电子排布式为CrO2Cl2是 分子(填“极性"或“非极性")。
-
(2) HC=CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为;乙炔钠中存在(填序号)。
A.金属键
B.σ键
C.π键
D.氢键
E.配位键
F.离子键
G.范德华力
-
(3) 分子式为[Pt( NH3)2Cl4]的配合物有两种不同的颜色,其中呈橙黄色的物质较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如图甲所示的结构示意图中呈亮黄色的是(填“A"或“B")。
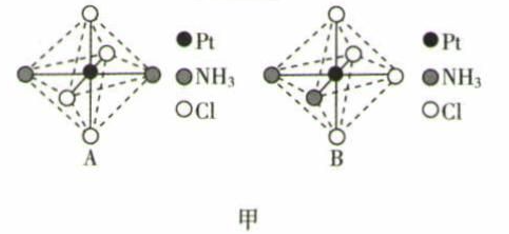
-
(4) 芦笋中的天冬酰胺具有提高身体免疫力的功效,结构如图乙所示。其组成元素第一电离能由大到小的顺序为(用元素符号表示)。
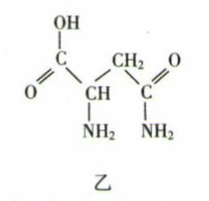
-
(5) 某离子晶体的晶胞结构如图丙所示:

①晶体中在每个X周围与它最近且距离相等的X共有个。
②设该晶体的摩尔质量为Mg·mol-1 , 晶体的密度为 ρg·cm-3 ,阿伏加德罗常数的值为NA , 则晶体中两个最近的X间的距离为pm。
下列叙述不正确的是( )
A . CO2和N2分子中所有原子都满足最外层8电子稳定结构
B . F2、Cl2、Br2、I2的熔点依次升高,与它们的分子间作用力依次增大有关
C . HCl溶于水的过程中克服了共价键
D . CaCl2和Ca(OH)2中化学键类型完全相同
下列有关共价化合物的说法:①具有较低的熔、沸点、②不是电解质、③固态时是分子晶体、④都是由分子构成、⑤液态时不导电,其中一定正确的是( )
A . ①③④
B . ②⑤
C . ①②③④⑤
D . ⑤
螯合树脂吸附法处理废水具有吸附容量大、速度快以及选择性好等特点,已成为近年来的研究热点。螯合树脂M与Cu2+形成新的螯合物Q,从而达到去除Cu2+的效果,吸附机理如图所示。

资料:
①吸附原理
螯合树脂M中的-COOH解离出H+ , 变成-COO- , 而且树脂中含有N原子,在与Cu2+接触时,树脂中的-COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
-
(1) M中四种元素电负性由大到小的顺序为(用元素符号表示)。
-
(2) M中N原子的杂化轨道类型为。
-
(3) Q中存在配位键,其中提供空轨道的是。
-
(4) 在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为时吸附效果最好。
②解释体系碱性过强时,吸附能力下降的原因。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因。
化学符号是我们的化学语言,下列有关化学用语使用正确的是( )
A . MgCl2的形成过程可表示为 B . 中子数比质子多3的氯原子:20Cl
C . HClO的结构式:H-O-Cl
D . Na2S的电子式为
B . 中子数比质子多3的氯原子:20Cl
C . HClO的结构式:H-O-Cl
D . Na2S的电子式为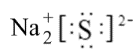
聚氨酯是一种应用广泛的有机材料,可根据需求调节其硬度,其结构片段如图。
![]() (R、R'表示短碳链,
(R、R'表示短碳链,![]() 表示长碳链)
表示长碳链)
下列有关聚氨酯的说法错误的是( )
A . 聚氨酯在一定条件下能发生水解
B . 聚氨酯中只含有酯基
C . 聚氨酯链之间可形成氢键,增大材料的硬度
D .  的值越大,聚氨酯材料的硬度越大
的值越大,聚氨酯材料的硬度越大
 的值越大,聚氨酯材料的硬度越大
的值越大,聚氨酯材料的硬度越大
以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
-
(1) 基态O原子的电子排布式,其中未成对电子有个。
-
(2) Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是。
-
(3) 酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取杂化。邻苯二甲酸酐(
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(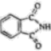 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。
-
(4) 金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。
-
(5) ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。
-
(6) 下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
最近更新



