原子核外电子的能级分布 知识点题库
构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是( )
A . E(4s)>E(3p)>E(3d)
B . E(3s)>E(3p)>E(3d)
C . E(6s)>E(4f)>E(5d)
D . E(5s)>E(4p)>E(3d)
下列说法正确的是( )
A . s能级的能量总小于p能级的能量
B . 2s的电子云半径比1s电子云半径大,说明2s的电子云比1s的多
C . 当电子排布在同一能级的不同轨道时,电子总是先占满一个轨道(1个原子轨道最多只能容纳两个电子,且自旋状态相反),然后再占据其他原子轨道
D . nf能级中最多可容纳14个电子
下列能级中可容纳电子数最多的是( )
A . 6s
B . 4p
C . 3d
D . 4f
根据电子排布的特点,Cu在周期表中属于( )
A . s区
B . ds区
C . d区
D . p区
有三种物质AC2、B2C2、AD4,元素A的最高正价和负价绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子的电子层结构与氩原子的相同,则:
-
(1) A、B、C、D的元素名称分别为、、、。
-
(2) AD4分子中含有的共价键类型为(填“σ键”或“π键”)。
-
(3) D的负一价阴离子的电子排布式为,B2C2的电子式为,属(填“离子化合物”或“共价化合物”)。
电子排布有能级顺序,若以E(nl)表示某能级的能量,以下各式中正确的是( )
A . E(4s)>E(3d)>E(3Px)>E(3Py)
B . E(3d)>E(4s)>E(3p)>E(3s)
C . E(5s)>E( 4f)>E(3Px)=E(3Py)
D . E(5s)>E(4s)>E( 4f)>E(3d)
下列说法正确的是()
A . 1s轨道的电子云形状为圆形的面
B . 2s的电子云半径比1s电子云半径大,说明2s能级的电子比1s的多
C . 电子在1s轨道上运动像地球围绕太阳旋转
D . 4f能级中最多可容纳14个电子
钛及其化合物的研究与应用越来越受到人们的重视。
-
(1) Ti(BH4)2是一种过渡元素硼氢化物储氢材料,可由TiCl4和LiBH4反应制得。
①在基态Ti2+中,电子占据的最高能层符号为,该能层具有的原子轨道数为
②LiBH4由Li+和BH4-构成,BH4-的立体结构是,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为。
③TiCl4在常温下是无色液体,则TiCl4属于(填“原子”“分子”或“离子”)晶体。
-
(2) 高分子纳米活性钛无霸是借助紫外线或太阳光的照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解生活中的一些有害物质(如苯、甲醛、丙酮等)。
①丙酮(
 )分子中含有π键与σ键数目之比为。
)分子中含有π键与σ键数目之比为。②甲醛(
 )分子中C原子轨道杂化类型为;
)分子中C原子轨道杂化类型为;甲醛易溶于水,原因是:a.甲醛和水都是极性分子,
B.。
-
(3) 某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有个,Ti原子的配位数为;该晶胞中N、Ti原子之间的最近距离为a nm,则该氮化钛晶体的密度为g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

过碳酸钠(2Na2CO3·3H2O2)晶体性质具有Na2CO3和H2O2
的双重性,被广泛用于氧气发生、漂白杀菌、污水处理、金属表面处理以及高分子聚合控制等。
-
(1) Na 原子的核外电子排布式为,O 原子核外 L 层上有种能量不同的电子,H2O2 的电子式是
-
(2) 设计一个简单实验,比较O 元素与其同主族短周期元素的非金属性强弱(简要写出实验方法、实验现象和结论);并用原子结构知识对作出的结论进行解释。
-
(3) 用一个离子方程式表示过碳酸钠溶液显碱性的原因。
-
(4) 高锰酸根离子(
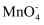 )水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
)水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下: 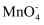 +CO
+CO  +H2O2→MnCO3¯+ +OH-+H2O
+H2O2→MnCO3¯+ +OH-+H2O 补全并配平上述化学反应过程式;反应中,过碳酸钠起沉淀剂和剂作用;若将 1L 含Mn 2000mg·L-1 的含高锰酸根离子的废水处理至含Mn 1.2mg·L-1 , 则转移电子数为mol(保留 2 位小数)
-
(1) I.N和Li、Na形成的Li3N、NaN3等化合物具有重要的用途。完成下列填空:
氮原子核外能量最高的电子所处的轨道是:。锂离子核外电子的轨道表示式是:。
-
(2) 已知Li3N熔点为845℃,NH3熔点﹣77.7℃,用物质结构的知识说明这两种含氮化合物熔点差异的可能原因。
-
(3) II.研究者发明了利用锂循环合成氨的工艺,其流程如下:

每合成1mol氨,转移电子mol;该过程最终得到的氧化产物是。
-
(4) 写出反应Ⅱ的化学反应方程式:。向0.35gLi3N中加入40mL1mol/L的盐酸,所得溶液中离子浓度由大到小的顺序是:。
-
(5) 由元素周期律能得到____________(填序号)。A . 碱性:LiOH<NaOH B . 与水反应的剧烈程度:Li<Na C . 溶解度:LiOH<NaOH D . 密度:Li<Na
-
(6) NaN3可用于汽车安全气囊,冲撞时发生如下反应:□NaN3+□KNO3→□K2O+□Na2O+□N2↑,配平此反应的化学方程式,并标出电子转移的数目和方向。
下列说法正确的是( )
A . 处于最低能量状态的原子叫基态原子
B . 2p3表示2p能级上有3个p轨道
C . 核外电子分层排布规律表明,多电子原子核外电子总是按能层次序从低到高依次填充
D . 同一原子中,2p、3p、4p能级的轨道数依次增多
硼氢化钠(NaBH4)是一种储氢密度较高、价格低廉、兼具安全性与稳定性的固态储氢材料。
-
(1) 基态B原子中电子占据最高能级的符号是,占据该能级电子的电子云轮廓图为形。基态B原子中,核外存在对自旋相反的电子。
-
(2) 在周期表中,与B元素的化学性质最相似的邻族元素是。
-
(3) 将物质的量之比为3∶1的NaBH4固体和ScF3固体混合研磨,得到的复合储氢体系可以显著降低放氢温度。基态21Sc原子的简化电子排布式为。
氮、磷、氟是组成化合物的重要元素。请回答下列问题:
-
(1) 基态磷原子的核外价电子排布图为。
-
(2) N、P、F三种元素的电负性由大到小的顺序为。
-
(3) PF3分子的空间构型为。
-
(4) N与F可形成化合物N2F2 , 下列有关N2F2的说法正确的是(填字母)。
a. 分子中氮原子的杂化轨道类型为sp2杂化
b. 其结构式为F-N=N-F
c. 其分子有两种不同的空间构型
d. 1 mol N2F2含有的σ键的数目为4NA(NA表示阿伏加德罗常数的值)
-
(5) 含氮元素的重要配离子[Cu(NH3)4]2+的结构示意图可表示为。
-
(6) 农药中通常含有磷元素,AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,其晶胞结构如图所示。

①磷化铝的晶体类型为。
②A、B点的原子坐标如图所示,则C点的原子坐标为。
③磷化铝的晶胞参数a=546.35 pm(1 pm=10-12m),其密度为g/cm3。(列出计算式即可,用NA表示阿伏加德罗常数的值)
【化学——选修3:物质结构与性质】
氮、磷、砷、铁、钛等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。
-
(1) I.如LiFePO4是新型锂离子电池的电极材料,可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。
基态Fe原子的价层电子排布式为,NH4H2PO4中,除氢元素外,其余三种元素电负性的大小关系是。
-
(2) 基态Cl原子有种空间运动状态的电子,属于区(填“s”“p”“d”“ds”)
-
(3) 苯胺(
 )和NH4H2PO4中的N原子杂化方式分别为。
)和NH4H2PO4中的N原子杂化方式分别为。
-
(4) 苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是。
-
(5) II.在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,取0.01mol该晶体加入到足量的硝酸银溶液中可得0.02mol白色沉淀,则该晶体中两种配体的物质的量之比为。
-
(6) III.从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的晶胞如图所示,该磷钇矿的化学式为。

-
(7) 已知晶胞参数为a nm和c nm,阿伏加德罗常数的值为NA , 则该磷钇矿的ρ为g·cm−3(列出计算式,用a、c表示)。
下列关于原子核外电子的说法错误的是( )
A . 电子运动的能量状态具有量子化的特征
B . 节日燃放的焰火与电子在一定条件下的激发与跃迁有关
C . 电子的运动状态可以用原子轨道描述,2p能级只有一个2p轨道
D . 多电子原子中,同一能层的电子,能量也可能不同
2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
-
(1) 基态Ga原子价电子排布式,核外电子占据最高能级的电子云形状为;基态As原子最高能层上有个电子。
-
(2) 镓失去电子的逐级电离能(单位:kJ•mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为和+3,砷的第一电离能比镓(填“大”或“小”)。
-
(3) 第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为。
-
(4) 砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为,AsH3分子的空间构型为。
-
(5) 相同压强下,AsH3的沸点NH3(填“大于”或“小于”),原因为。
-
(6) GaAs为原子晶体,其晶胞结构如图所示,Ga与As以(填“共价键”或“离子键”)键合。设阿伏加德罗常数的值为NA , 该晶胞边长为a pm则GaAs晶体的密度为g•cm-3(列出计算式即可)。

下列有关原子结构的认识不正确的是( )
A . 同一原子的能层越高,s电子云半径越大
B . s区全部是金属元素
C . 氮原子的最外层电子的轨道表示式: D . 多电子原子中同一能层不同能级的电子能量不同
D . 多电子原子中同一能层不同能级的电子能量不同
 D . 多电子原子中同一能层不同能级的电子能量不同
D . 多电子原子中同一能层不同能级的电子能量不同
下列说法不正确的是( )
A . 基态碳原子的核外电子轨道表示式: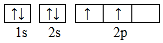 B . 基态原子的核外电子填充在6个轨道中的元素有两种
C . 基态铜原子简化电子排布式表示为
B . 基态原子的核外电子填充在6个轨道中的元素有两种
C . 基态铜原子简化电子排布式表示为 违背了泡利原理
D . 基态钾离子
违背了泡利原理
D . 基态钾离子 电子占据的最高能级共有3个原子轨道,其形状是哑铃形
电子占据的最高能级共有3个原子轨道,其形状是哑铃形
 B . 基态原子的核外电子填充在6个轨道中的元素有两种
C . 基态铜原子简化电子排布式表示为
B . 基态原子的核外电子填充在6个轨道中的元素有两种
C . 基态铜原子简化电子排布式表示为 违背了泡利原理
D . 基态钾离子
违背了泡利原理
D . 基态钾离子 电子占据的最高能级共有3个原子轨道,其形状是哑铃形
电子占据的最高能级共有3个原子轨道,其形状是哑铃形
在核电荷数为1~36的元素中,原子的最外层电子排布满足ns1的元素共有( )
A . 4种
B . 5种
C . 6种
D . 7种
辉铜矿(主要成分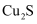 )可以用于制铜,化学反应方程式为
)可以用于制铜,化学反应方程式为 , 制得的粗铜(含
, 制得的粗铜(含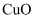 等杂质)可通过电解法进行精炼,下列相关说法正确的是( )
等杂质)可通过电解法进行精炼,下列相关说法正确的是( )
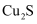 )可以用于制铜,化学反应方程式为
)可以用于制铜,化学反应方程式为 , 制得的粗铜(含
, 制得的粗铜(含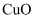 等杂质)可通过电解法进行精炼,下列相关说法正确的是( )
等杂质)可通过电解法进行精炼,下列相关说法正确的是( )
A . 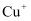 转化为基态
转化为基态 , 得到的电子填充在
, 得到的电子填充在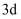 轨道上
B . S元素的电负性大于O元素的电负性
C . 电解精炼铜时,粗铜应与电源的负极相连
D . 如图所示的
轨道上
B . S元素的电负性大于O元素的电负性
C . 电解精炼铜时,粗铜应与电源的负极相连
D . 如图所示的 晶胞中,黑球表示的是
晶胞中,黑球表示的是
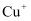 转化为基态
转化为基态 , 得到的电子填充在
, 得到的电子填充在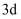 轨道上
B . S元素的电负性大于O元素的电负性
C . 电解精炼铜时,粗铜应与电源的负极相连
D . 如图所示的
轨道上
B . S元素的电负性大于O元素的电负性
C . 电解精炼铜时,粗铜应与电源的负极相连
D . 如图所示的 晶胞中,黑球表示的是
晶胞中,黑球表示的是
最近更新



