原子核外电子的能级分布 知识点
原子核外电子的能级分布:核外电子根据能量的不同分布能层,从离核由近到远分为7个能层,每个能层又分为不同的能级,每个能层数刚好等于能层序数。 不同能级的表示符号是S、P、d、f等。
原子核外电子的能级分布 知识点题库
下列各能层不包含d能级的是
A . O能层
B . P能层
C . M能层
D . K能层
按电子排布,可把周期表里的元素划分成5个区,以下元素属于d区的是( )
A . Na
B . Mg
C . P
D . Fe
下列各原子或离子的电子排列式错误的是
A . Na+ 1s22s22p6
B . F¯1s22s22p6
C . N3+ 1s22s22p6
D . O2¯1s22s22p6
下列关于能层与能级的说法中正确的是( )
A . 原子核外电子的每一个能层最多可容纳的电子数为2n2
B . 任一能层的能级总是从s能级开始,而且能级数不一定等于该能层序数
C . 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D . 1个原子轨道里最多只能容纳2个电子,但自旋方向相同
下列有关认识正确的是( )
A . 各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7
B . 各能层的能级都是从s能级开始至f能级结束
C . 各能层含有的能级数为n﹣1
D . 各能层含有的电子数为2n2
以下能级符号不正确的是( )
A . 6s
B . 2d
C . 3p
D . 7f
下列各项叙述中,正确的是( )
A . 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B . 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是S区元素
C . 所有原子任一能层的S电子云轮廓图都是球形,但球的半径大小不同
D . 24Cr原子的电子排布式是:1s22s22p63s23p63d44s2
以下能级符号正确的是( )
A . 3f
B . 2d
C . 4s
D . 2f
-
(1) M能层上有个能级,有个轨道,作为内层最多可容纳个电子,作为最外层时,最多可含有个未成对电子。
-
(2) E原子核外电子占有9个轨道,且具有1个未成对电子,E离子结构示意图是。
-
(3) F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是,F2-的电子排布式是。
下列硼(B)原子电子排布式表示的状态中,能量最高是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
草酸铁铵{(NH4)3[Fe(C2O4)3]}常用于摄影和蓝色印刷等,其制备原理为:Fe(OH)3+3NH4HC2O4=(NH4)3[Fe(C2O4)3]+3H2O。
回答下列问题:
-
(1) 基态C原子核外电子云有种形状;基态铁原子最先失去能级(填能级符号)上的电子。
-
(2) (NH4)3[Fe(C2O4)3]中C2O
 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。 ①该配合物中所含非金属元素的电负性由大到小的顺序为 (用元素符号表示)。
②上述配合物的中心离子配位数为。
③1molC2O
 中含有σ键的数目为在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键简称大π键。如苯的大π键可表示为
中含有σ键的数目为在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键简称大π键。如苯的大π键可表示为  (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O  的大π键可表示为。
的大π键可表示为。 -
(3) 写出一种与NH
 所含价电子数和原子总数均相等微粒的化学式;N元素的一种同素异形体N4中所有原子均满足8电子稳定结构,N4的结构式为;CH4、NH3、H2O分子中键角由大到小的顺序为。
所含价电子数和原子总数均相等微粒的化学式;N元素的一种同素异形体N4中所有原子均满足8电子稳定结构,N4的结构式为;CH4、NH3、H2O分子中键角由大到小的顺序为。
-
(4) 铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为 g·cm-3。
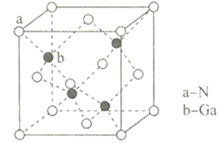
氮化镓(GaN)结构与金刚石类似,是一种半导体材料,因其具有良好的电学特性,广泛的应用于电子行业,近年智能手机的快速充电器中就使用了氮化镓材料。
-
(1) 基态N原子的电子排布式为;基态Ga原子核外电子能量最高的电子占据的能级为。
-
(2) GaN、GaP、GaAs熔点如下表所示,分析其变化原因。
晶体
GaN
GaP
GaAs
熔点/℃
1700
1480
1238
-
(3) GaN可在高温下由金属Ga和NH3反应制取。N原子和H原子可以形成多种微粒,如:NH3、NH
 、NH
、NH  、N2H4、N2H
、N2H4、N2H 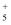 、N2H
、N2H 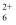 等。在N2H
等。在N2H 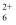 中,N原子的杂化方式为。与N2H
中,N原子的杂化方式为。与N2H 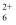 互为等电子体的物质是(写出一种);在N2H
互为等电子体的物质是(写出一种);在N2H 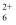 中存在的化学键类型有。
中存在的化学键类型有。 a.极性键 b.非极性键 c.离子键 d.配位键
-
(4) GaN的晶胞结构如图所示:其中与Ga原子最近的N原子所构成的空间结构为;若GaN晶体的密度为6.1 g/cm3 , 阿伏加德罗常数为NA , 则距离最近的两个N原子间的距离为nm(写出表达式即可)。
已知Mn、Fe、Co是合金中的重要元素,而P、S、Cl是农药中的重要元素。请回答下列问题:
-
(1) 基态锰原子的价电子排布图为。
-
(2) 已知PCl3的沸点高于SCl2 , 原因是。
-
(3) 以无水乙醇作溶剂,Co(NO3)2可与某多齿配体结合形成具有催化活性的配合物,其结构如图所示,下列说法错误的是___________。
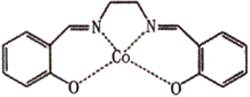 A . 第一电离能:H<O<N B . 该配合物中C原子的杂化方式均为sp C . 该配合物中Co原子的配位数为4 D . 基态Co原子核外电子的空间运动状态有27种
A . 第一电离能:H<O<N B . 该配合物中C原子的杂化方式均为sp C . 该配合物中Co原子的配位数为4 D . 基态Co原子核外电子的空间运动状态有27种 -
(4) 水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与Mn2+形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与Mn2+形成配位键的原子有(填元素符号),锰试剂(填“能”或“不能”)形成分子内氢键。
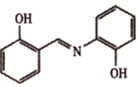
-
(5) 阿拉班达石(alabandite)是一种属于立方晶系的硫锰矿,其晶胞如图a所示(●=Mn,○=S)。在该晶胞中,硫原子的堆积方式为。
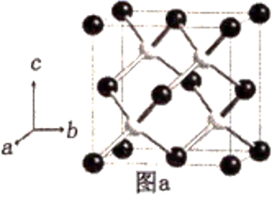
-
(6) 已知阿拉班达石晶胞中最近两个硫原子之间的距离为dÅ(1Å=10-10m),晶体密度为ρg▪cm-3 , 则阿伏加德罗常数的值NA=(不要求化简)。
-
(7) 为更清晰地展示晶胞中原子所在的位置,晶体化学中常将立体晶胞结构转化为平面投影图。例如:沿阿拉班达石晶胞的c轴将原子投影到ab平面,即可用图b表示。下列晶体结构投影图可能表示MnO2晶体的是___________。
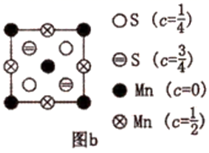 A .
A .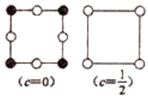 B .
B .  C .
C .  D .
D . 
钛(Ti)被称为“未来世界的金属”,广泛应用于国防、航空航天、生物材料等领域。请回答下列问题:
-
(1) 基态Ti2+的价电子排布图。与钛同周期的过渡元素中,基态原子未成对电子数最多的元素为(写元素名称)。
-
(2) 与钛同周期的第ⅡA族和ⅢA族两种元素中第一电离能较小的是(写元素符号),原因是。
-
(3) 四乙醇钛Ti(OCH2CH3)4能增加橡胶在金属表面的黏附性,该物质可溶于有机溶剂,常温下为淡黄色透明液体,其固体的晶体类型为;该物质中非金属元素的电负性从大到小的顺序。
-
(4) 钛的氯化物TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为。
-
(5) 钙钛矿CaTiO3有两种构型(A型和B型)。
①其中A型的晶胞如图所示,晶胞边长为a nm,CaTiO3的相对式量为M,阿伏加德罗常数的值为NA , 其晶体密度的计算表达式为g.cm-3。
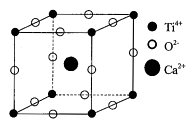
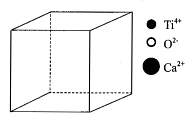
②如果将晶胞原点移到Ca2+上,就是CaTiO3的B型结构。请在虚线框内图示画出B型晶胞的结构图。(注意请用黑色签字笔作图)
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。下列有关电子云的说法正确的是( )
A . 概率密度的大小体现了电子数目的多少
B . 概率密度的大小体现了空间某处电子出现概率的大小
C . 基态C原子的1s电子的电子云和2s电子的电子云完全相同
D . 基态Li原子的1s电子的电子云和2s电子的电子云形状不同
下列说法不正确的是( )
A .  和
和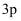 轨道均为哑铃形
B . 从空间角度看,
轨道均为哑铃形
B . 从空间角度看,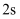 轨道比
轨道比 轨道大,其空间包含了
轨道大,其空间包含了 轨道
C . 用光谱仪摄取各种元素原子的吸收光谱即为原子光谱
D . 整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定
轨道
C . 用光谱仪摄取各种元素原子的吸收光谱即为原子光谱
D . 整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定
 和
和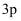 轨道均为哑铃形
B . 从空间角度看,
轨道均为哑铃形
B . 从空间角度看,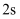 轨道比
轨道比 轨道大,其空间包含了
轨道大,其空间包含了 轨道
C . 用光谱仪摄取各种元素原子的吸收光谱即为原子光谱
D . 整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定
轨道
C . 用光谱仪摄取各种元素原子的吸收光谱即为原子光谱
D . 整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定
下列属于基态排布的原子或离子核外电子排布式的是( )
A . Br-:3d104s24p6
B . Cr:[Ar]3d54s1
C . Na:1s22s22p53s2
D . Fe2+:[Ar]3d64s2
反应 可用于制备火箭推进剂的燃料
可用于制备火箭推进剂的燃料 。下列有关说法正确的是( )
。下列有关说法正确的是( )
 可用于制备火箭推进剂的燃料
可用于制备火箭推进剂的燃料 。下列有关说法正确的是( )
。下列有关说法正确的是( )
A .  的结构式为
的结构式为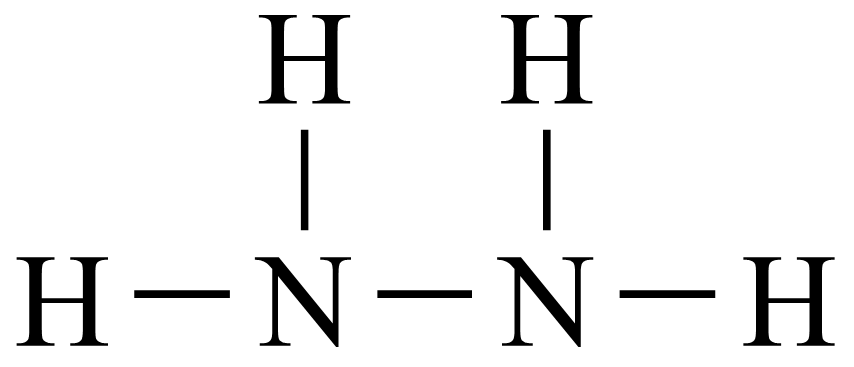 B . 中子数为8的氮原子可表示为
B . 中子数为8的氮原子可表示为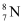 C . O基态原子的价层电子排布式为
C . O基态原子的价层电子排布式为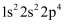 D . NaCl的电子式为
D . NaCl的电子式为
 的结构式为
的结构式为 B . 中子数为8的氮原子可表示为
B . 中子数为8的氮原子可表示为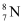 C . O基态原子的价层电子排布式为
C . O基态原子的价层电子排布式为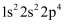 D . NaCl的电子式为
D . NaCl的电子式为
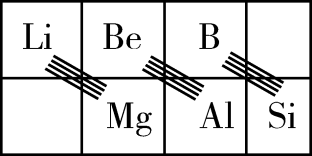
硅是典型的半导体元素,在电子、材料等领域应用广泛。请回答下列问题:
-
(1) 基态硅(Si)原子的核外电子排布式为。
-
(2) 碳(C)、硅(Si)、锗(Ge)是同族元素。
①基态C原子的价层电子排布图为;基态C原子核外电子的空间运动状态有种。
②基态Si原子的核外电子占据个能层,个能级。
③Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为,微粒之间存在的相互作用是。
④Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是。
-
(3) 在元素周期表中,某些元素与其右下方的主族元素(如图所示)的一些性质是相似的。如Be与Al的化学性质相似,Be与NaOH溶液反应生成Na2BeO2和H2 , 请写出Be(OH)2与NaOH溶液反应的离子方程式。
-
(1) 钛铁合金具有吸氢特性,工业在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景,基态Ti原子核外有个运动状态不同的电子,在基态
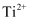 中,电子占据的能量最高的轨道为。
中,电子占据的能量最高的轨道为。
-
(2) 过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般为
 或
或 排布时,无颜色;为
排布时,无颜色;为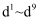 排布时,有颜色。如
排布时,有颜色。如 显粉红色,据此判断
显粉红色,据此判断 (填“无”或“有”)颜色。
(填“无”或“有”)颜色。
-
(3) 利用CO可以合成化工原料
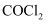 、配合物
、配合物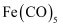 等。
等。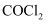 分子的空间构型为;
分子的空间构型为;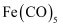 在一定条件下发生分解反应:
在一定条件下发生分解反应: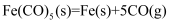 , 反应过程中,断裂的化学键只有配位键,则形成的化学键类型是。
, 反应过程中,断裂的化学键只有配位键,则形成的化学键类型是。
-
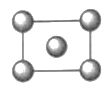
(4) 最近,由镁、镍和碳三种元素组成的化合物引起了科学家的注意。据报道,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素。从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积(如图),则该晶体中镁、碳、镍三种元素的原子个数比是,晶体中每个镁原子周围距离最近的镍原子有个。(图中:碳原子用小
 球在晶体的体心,镍原子用大
球在晶体的体心,镍原子用大 球,镁原子用大
球,镁原子用大 球)
球)
最近更新



