原子结构与元素的性质 知识点
原子结构与元素的性质;原子最外层电子数的多少决定元素原子得失电子的能力,一般元素原子最外层电子数大于4,说明该元素原子容易得到电子,小于4则该元素原子失去电子。同周期元素原子的半径大小受原子核内质子数影响,质子数越大,吸引电子的能力越强,半径越小。
原子结构与元素的性质 知识点题库
根据表中信息,下列叙述正确的是( )
短周期元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6,-2 | -2 |
A . 氢化物的热稳定性:H2T<H2R
B . 单质与稀盐酸反应的速率:L<Q
C . 离子半径:R2-<L2+
D . M与T形成的化合物既能与强酸反应,又能与强碱反应
短周期元素W,X,Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
A . 元素W,X的氯化物中,各原子均满足8电子的稳定结构
B . 元素X与氢形成的原子比为1:1的化合物有很多种
C . 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D . 元素Z可与元素X形成共价化合物XZ2
请填写表格.
微粒 | 质子数 | 中子数 | 质量数 | 最外层电子数 | ZAX |
Al | 27 | ||||
S2﹣ | 1634S2﹣ |
等物质的量的主族金属A,B,C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC , 已知VB=2VC , VA=VB+VC , 则在C的生成物中,该金属元素所在的主族是( )
A . ⅠA
B . ⅡA
C . ⅢA
D . 无法确定
第3周期元素R,它的原子核外层上达到饱和所需电子数小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍.则关于R的正确说法是( )
A . 常温下,能稳定存在的R的高价氧化物都能与烧碱溶液反应
B . R的最高价氧化物对应水化物是强酸
C . R和R的氧化物的熔点和硬度都很高
D . R能形成稳定的气态氢化物
已知A,B,C,D的原子序数都不超过18,.它们的离子aA(n+1)+ , bBn+ , cC(n+1)﹣ , dDn﹣ 均具有相同的电子层结构,则下列叙述正确的是( )
A . 原子序数:a>b>c>d
B . 离子半径:A(n+1)+>Bn+>C(n+1)﹣>Dn﹣
C . 原子半径:A>B>C>D
D . 单质还原性:B>A,单质氧化性:D>C
X,Y,Z,R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )
A . 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R)
B . 含有Y,Z,R三种元素的化合物最多只有2种
C . 元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂
D . Y与Z能形成Z2Y和Z2Y2两种不同的化合物,它们的晶体类型相同
下列说法正确的是( )
A . 若原子X的质子数为a,则X的质量数一定不为a
B . 若两种元素形成的离子M2﹣和N+电子层结构相同,则离子半径M2﹣>N+
C . 同周期非金属氧化物对应水化物酸性从左到右依次增强
D . 由两种元素组成的化合物,若含有离子键,就没有共价键
用A、B、C、D、E和F表示含有10个电子的微粒(离子或分子),请回答:
-
(1) A离子为单核离子且A原子在所在周期中原子半径最大,A离子是
-
(2) C是由两种元素组成的分子,其水溶液呈碱性,其分子式是
-
(3) D是由两种元素组成的三原子分子,电子式是
-
(4) 向B中加入F先出现白色沉淀继续加入F沉淀溶解,写出该过程的离子方程式
-
(5) E+F→C+D写出该方程式.
2016年IUPAC命名117号元素为Ts(中文名“ ![]() ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A . Ts是第七周期第ⅦA族元素
B . Ts的同位素原子具有相同的电子数
C . Ts在同族元素中非金属性最弱
D . 中子数为176的TS核素符号是 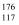 Ts
Ts
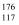 Ts
Ts
下列说法正确的是( )
A . 金属与非金属元素形成的化合物一定是离子化合物
B . 干冰气化过程中只需克服分子间作用力
C . HF的热稳定性很好,是因为HF分子间存在氢键
D . 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构
下列分子或离子中不能跟质子结合的是( )
A . NH3
B . H2O
C . Ca2+
D . OH﹣
某元素的原子最外层只有一个电子,它跟卤素原子结合时( )
A . 一定形成共价键
B . 可能是共价键,也可能是离子键
C . 一定是离子键
D . 以上说法都不对
下列说法正确的是( )
A . 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B . 只有非金属元素才能形成含氧酸盐
C . 主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同
D . 非金属元素的最高价含氧酸都具有强氧化性
X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为.
下列说法正确的是( )
① H2O2 分子中既含极性键又含非极性键
② F2、Cl2、Br2、I2 熔点随相对分子质量增大而升高
③Na2O2 固体中的阴离子和阳离子个数比是 1∶2
④由于非金属性 Cl > Br > I,所以酸性 HCl > HBr > HI
A . ②③④
B . ①③④
C . ①②③
D . .①②③④
A、B、C 3种元素的核外电子数都比氩原子少,若A和C处于同一主族,A和B的核电荷数之差为5,B原子的M电子层比L电子层少2个电子,则A、B、C 3种元素可能分别为( )
A . Li、Na、S
B . Na、S、Li
C . Na、K、Br
D . K、Br、Na
已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( )
A . 原子半径:A>B>C>D
B . 原子序数:d>c>b>a
C . 离子半径:C>D>B>A
D . 元素的第一电离能:A>B>D>C
主族元素W、X、Y、Z的原子序数依次增大,且均不大于20,W与Y原子的最外层电子数之和等于X原子的最外层电子数。这四种元素形成的一种食品添加剂Q的结构如图所示。下列说法正确的是( )
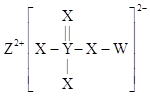
A . 原子半径:W<Y<X<Z
B . W与Z形成的化合物中含有共价键
C . X与Y形成的化合物可用作食品干燥剂
D . Q中不是所有原子都满足8电子稳定结构
X、Y为第三周期元素,Y最高正价与最低负价的代数和为6,二者形成的一种化合物在固态时以[XY4]+[XY6]-的形式存在。下列说法正确的是( )
A . 该化合物中含有离子键和共价键,为共价化合物
B . 简单氢化物的稳定性:X>Y
C . 同周期元素氧化物对应的水化物中,Y元素氧化物对应水化物的酸性最强
D . 阴离子[XY6]-和阳离子[XY4]+中,X原子杂化方式和离子空间构型均不相同
最近更新



