键能、键长、键角及其应用 知识点
键长及其应用: 两个成键原子A和B的平均核间距离。是了解分子结构的基本构型参数,也是了解化学键强弱和性质的参数。可以由实验测量得到。键长是分子结构的重要参数之一,它对于讨论化学键的性质,研究物质的微观结构以及阐明微观结构与宏观性能之间的关系等方面都具有重要作用。
键角及其应用: 键角是指在分子中,一个原子与其他两个原子形成的两个化学键之间的夹角叫做键角。键角是反映分子空间结构的重要因素之一。从原则上说,键角可以用量子力学近似方法计算出来,但对复杂分子,但实际上键角还是通过光谱、衍射等结构实验测定的。 键角是共价键方向性的反映,与分子的形状(空间构型)有密切联系。例如,水分子中两个H—O键之间的夹角是104.5°,这就决定了水分子的角形结构。
键能、键长、键角及其应用 知识点题库
 2NH3(g) ΔH=-92.4 kJ·mol-1,则N≡N键的键能是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,则N≡N键的键能是( )
回答下列问题:
-
(1) 常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=mol/L( 列出计算式即可)。
-
(2) 合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为kJ/mol.
-
(3) 二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g)
 CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。 ①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=;该温度下,该反应的平衡常数K=。
②下列能说明该反应达到平衡状态的是(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=
 )的影响,该反应的ΔH0(填“>”“<”或“=”);控制的最佳温度是.
)的影响,该反应的ΔH0(填“>”“<”或“=”);控制的最佳温度是.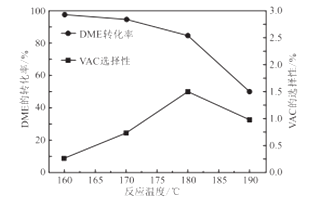
④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡(填“向正反应方向”“向逆反应方向"或“不”)移动。
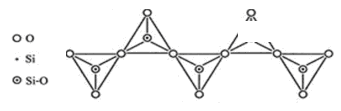 图b
图b 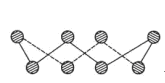
-
(1) 基态Se原子核外电子排布式为[Ar]。
-
(2) K与Cu位于同周期,金属钾的熔点比铜的低,这是因为。
-
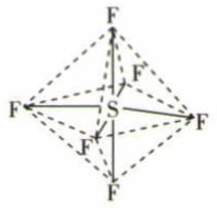
(3) O、S、Se均位于元素周期表第VIA族,它们的氢化物H2O、H2S、H2Se分子的键角从大到小顺序为。
-
(4) 配合物[Cu(CH3CN)4]BF4中,阴离子的空间构型为,配合离子中与Cu(Ⅱ)形成配位键的原子是,配体中碳原子的杂化方式是。
-
(5) TMTSF(
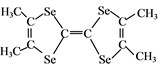 )中共价键的类型是,每个分子中含个σ键。
)中共价键的类型是,每个分子中含个σ键。
-
(6) Cu、Sb、Se组成的热电材料,其晶胞结构如图所示,a=b=566pm,c=1128pm,该晶体的密度为(列出计算表达式)g·cm-3。

-
(1) 传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
②C2H6(g)+
 O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1已知反应相关的部分化学键键能数据如下:
化学键
H-H(g)
H-O(g)
O=O
键能(kJ·mol-1)
436
x
496
由此计算x=,通过比较ΔH1和ΔH2 , 说明和热裂解法相比,氧化裂解法的优点是(任写一点)。
-
(2) 乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图甲为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是,反应的最佳温度为(填序号)。
A.700℃ B.750℃ C.850℃ D.900℃
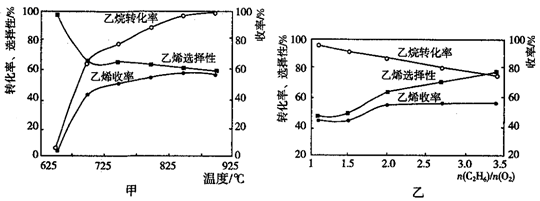
[乙烯选择性=
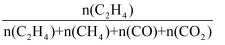 ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性] -
(3) 烃类氧化反应中,氧气含量低会导致反应产生积炭堵塞反应管。图乙为
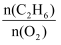 的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中
的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中 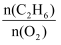 的最佳值是,判断的理由是。
的最佳值是,判断的理由是。
-
(4) 工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是。反应达平衡时,各组分的体积分数如下表:
组分
C2H6
O2
C2H4
H2O
其他物质
体积分数/%
2.4
1.0
12
15
69.6
计算该温度下的平衡常数:Kp=(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。
-
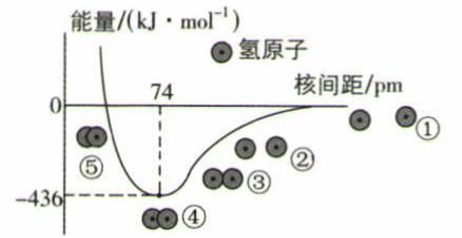
(1) H-H键的键长为,①~⑤中,体系能量由高到低的顺序是。
-
(2) 下列说法中正确的是____(填序号)。A . 氢分子中含有一个π键 B . 由①到④,电子在核间出现的概率增大 C . 由④到⑤,必须消耗外界的能量 D . 氢分子中含有一个极性共价键
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | |||||||||||||||
⑧ | ⑨ | ⑩ |
请回答下列问题:
-
(1) 元素②形成的含氧酸中,酸根离子呈正三角形的酸是(填化学式)。
-
(2) 元素②③⑧的第一电离能由大到小的顺序是(填元素符号)。
-
(3) 元素④⑥⑦的简单气态氢化物中最稳定的是(填化学式),元素⑤⑧的最高价氧化物对应水化物反应的离子方程式为。
-
(4) 写出元素⑨的基态原子的价电子排布式:。
-
(5) 将元素⑩的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来)。
-
(6) 元素①和②③形成的:二元共价化合物中,分子呈三角锥形的化合物为(填化学式);分子中既含有极性共价键,又含有非极性共价键的化合物有(填化学式,写一种)。
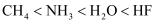 B . 键角:
B . 键角: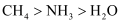 C . 沸点:正丁烷<异戊烷
D . 沸点:
C . 沸点:正丁烷<异戊烷
D . 沸点: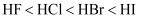
 , M是一种过渡元素
, M是一种过渡元素



